

TOPICS
CHNフォーラム
第一部 酸素プラズマによる低温灰化技術
- 1-1.はじめに
- 2-1. 気体の放電
- 3-1.プラズマ化学装置
- 4-1.プラズマ化学反応
- 5-1.食品および生体試料の灰化
- 6-1.電子顕微鏡による観察
- 6-2.光学顕微鏡による観察
- 7-1.おわりに
- 8-1.参考文献
- 関連装置
1-1.はじめに
化学の比較的新しい領域に気体放電を利用したプラズマ化学があります。まだ化学教育に一般的に取り入れられてはいませんが,そのユニークな可能性が次第に注目されています。「プラズマ」の用語は本来気体の電気放電に由来していますが,最近はプラズマテレビの名称で一般人にも馴染みが出てきました。液晶テレビに比べてプラズマテレビは大画面に向いているので,年々需要が増えています。放電によって光が出ることは古くからネオンサインや蛍光灯に利用され,自然現象としても雷の閃光やオーロラで人類に知られていました。電気工学の取り扱う対象の中で放電は重要な物理現象として扱われていましたが,化学的な側面には気がつかず,一方化学者は誰も電気工学の領域に足を踏み入れようとしませんでした。
1962年Analytical Chemistry誌に米国Tracerlab社のC. E. Gleitらによる短い論文が掲載されました1)。内容はガラス管にコイルを巻き,一方から酸素を供給しながら,他方から真空ポンプで減圧します。コイルに高周波電力を加えると酸素は電気エネルギーを吸収して一部が原子状酸素になり,もし管内に有機物があれば表面からゆっくり酸化燃焼し,灰を残すと言うものです。殆ど熱を発せず有機物だけを燃焼除去しますから無機成分の回収率が向上します.一方有機元素分析の分野でも灰分(はいぶん)の定量という昔からのテーマがあって,るつぼやボートに入れた試料を高温で燃焼し,残留物を測定していましたから,低温で燃焼できるこの新しい技術は興味を引きました。ただその後続報も出ず,また13.56 MHzの高周波発振器が必要で,その入手や扱いに化学者はすぐには対応できませんでした。
1966年同じ会社のJ. R. HollahanはJ. ChemicalEducation誌に上の論文の詳しい紹介記事を書き2),装置構造から応用例までを挙げて化学の新しい方法として登場させました(図1)。われわれ分析化学者もようやく新技術の実態を知って,研究テーマに取り上げるようになりました.時期を同じくしてオーストラリアの国立化学研究所のF. K. McTaggartが1967年 “Plasma Chemistry in Electrical Discharge”という著書を出版し3),ここで始めて “Plasma Chemistry” や日本語で「プラズマ化学」という用語が使われるようになりました。ただMcTaggartの本は物理化学を中心に書かれていますので,応用を期待する化学者には少し距離感があったようです。ともあれプラズマ化学の応用はこれを契機に急速に広がり,分析化学,生物科学,半導体工業の領域で大きな成果を挙げるようになりました。常温に近い温度で有機物を静かに除去するので,残された生体内の無機質の構造がそのまま観察できます。半導体工業では回路パターンを焼き付けた光レジスト膜を最後に酸素プラズマで除去するのに使われ,その後この技術の延長線上にフレオンプラズマによるシリコンのエッチングが可能となり,それによって大規模集積回路の形成が可能となりました。世界中のコンピュータの記憶媒体がプラズマ化学技術で製造されていることを思うと,1962年C. E. Gleitが最初に分析化学の学術誌に発表した論文は歴史に残るもので,それを啓発したJ. R. Hollahan(図2)の功績は極めて大きいと言わなければなりません。
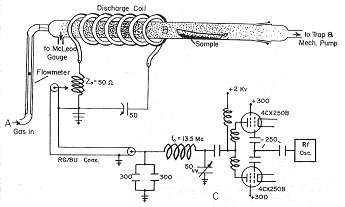
図1 酸素プラズマ灰化装置

図2 Dr.J. R. Hollahan
1964年ごろから米国農業研究所のR. S. Thomasは細菌など生物試料のプラズマ灰化(はいか)を始め,灰化像の電子顕微鏡観察を次々と報告しました4, 5)。驚くべき無機質の超微細構造を写真に展開してこの灰化法の特質が明らかになりました。筆者もこれに触発されて早速簡単なプラズマ装置を京都の柳本製作所に作ってもらい,有機試料の灰化実験を始めると共に植物組織の灰化像を光学顕微鏡で観察しました.1970年代になるとこのプラズマ技術はさらに進化して,エチレンやスチレンなど気体モノマーから固体材料上に均一な高分子薄膜を形成するプラズマ重合法としても利用されるようになり,表面コーティングやろ過膜の製造などに多彩な成果を挙げました。広範な応用分野を持つプラズマ化学は21世紀に入っても引き続き先端技術を支える重要な原動力になっています6, 7, 8)。本稿ではまずプラズマ化学の出発点となった酸素プラズマの原理と応用について概略の解説をします。
2-1. 気体の放電
われわれの周辺の物質は温度を持っていますが,温度とは大ざっぱに言って分子や原子の運動エネルギーです.運動エネルギーの実体は,気体では分子の飛行速度,液体ではブラウン運動,固体では原子間振動で系に蓄えられています。常温のアルゴン分子(Mw=39.95)の自由行程について計算すると運動エネルギーは平均速度に換算して時速1300 Kmになりますが,ジャンボジェット機より速く,コンコルド機に匹敵します(図3)。空気中の窒素や酸素は分子量がアルゴンより小さいのでもう少し高速になるでしょう.そんな衝撃を受けながら空気の中で生活しているわれわれは不思議に思われますが,逆に言えばその程度の衝突エネルギーでは目立った化学反応はあまり起きないということになります。しかし温度をどんどん上昇すると分子間の衝突が激しくなり,有機物は酸素と反応して燃焼を始めますが,さらに超高温になると遂に分子は軌道電子を放出して自由電子と陽イオンになります。図4は水素分子の衝突の模様を示していますが,2原子分子の原子間結合が切れてラジカル種の原子状水素が生成し,同時に電子,陽子,未解離の水素分子が混在しています。太陽表面は約6000℃の水素ガスで覆われていますが,激しい分子衝突によって構成が破壊し,いろいろな解離種を含む「高温プラズマ」の状態になっています。
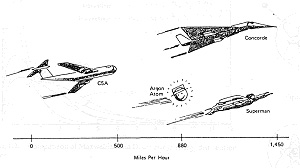
図3 アルゴン分子の速度

図4 水素のプラズマ解離
超高温の気体が解離した状態では+-の電場を与えると電子と陽イオンが反対電場に引かれるので,気体中に電流を流して放電させることができます。放電空間には陽イオン,ラジカルなど化学反応に使えるものがありますが,何分超高温では近寄ったり,中に材料を入れて加工したりすることができません。一方真空ポンプが発明され低圧気体についていろいろな実験が出来るようになると,英国のM. Faraday (1791―1867) は1835年ガラス管内で両端に電極を入れ数百ボルトの電圧を加えると光を伴う放電が起こることを知りました。これは低圧の故に気体の分子間距離が著しく長くなり,自由電子が長い距離電場で加速されて高い速度エネルギーを獲得し,それが気体分子に衝突するからです。単純計算では1 Torr (1 mmHg, 100 Pa)に減圧すると自由電子の速度エネルギーは常圧に比べ760倍となります。電子が著しい高速を獲得する反面,陽イオンは質量が大きいのであまり加速されず,ラジカル種や未解離の分子は全く加速されません。この状況は図4の水素の「低温プラズマ」で説明されます。言い方を変えると,電子だけが著しく高温で,その他の陽イオンやラジカル種は常温ということになります。気体空間に高温と常温の粒子が同居するので,非平衡のプラズマ状態と言いますが,電子温度Teとガス温度Tgが分離する様子を圧力の変化と共に示すと図5のようになります。100 Torr以下でTeとTgの分離が始まりますが,1 Torrになると電子温度は1万度近くになる一方,ガス温度は次第に常温に近づいてきます。

図5 電子温度とガス温度の分離
この電離気体の性質は英国のW. Crookes (1832-1919) によって次第に明らかにされ,その特異な物性から従来の固体,液体,気体と言う物質の3態に対し,1879年に “Fourth dimentional state”,「第四の状態」を加えました。1924年米国のI. Langmuir (1881-1957) は放電管の中で神秘的に揺らぐ光を見て生命の誕生を連想し,この物質に “Plasma”,「プラズマ」の名称を与えました。もともとはギリシャ語で「流動物から形づくる」と言う意味のようですが,「プラスチック」もどろどろしたものから固めたものと言う意味で,プラズマと同じ語源から来ています。
プラズマに来るまでの説明が長くなりましたが,低圧気体では自由電子が電場の方向に長い距離加速され,高い速度エネルギーを獲得します。中性の気体中には本来自由電子は無いように思われますが,空間には絶えず宇宙線が降り注いでいて,これの衝撃を受けた原子から僅かな量の自由電子が放出されます。またガラス管に含まれる微量の放射性元素から出る放射線もこれに加わります。初期電子が僅かでもあれば,あとは電場の加速による高エネルギーで中性気体から雪崩のように自由電子が放出されて,放電空間は高密度のプラズマ状態になります。気体温度が低い低温プラズマは実験室で扱い易いので,太陽表面などの高温プラズマとは一線を画しています。
低温プラズマは古くから電気工学の素材で,ネオンサインや蛍光灯などガラス管の中から光を取り出すことに集中しました。光源がガラス管の中に封じ込まれているので,その中で陽イオンやラジカル種など化学反応に有用なものがあっても,電気工学者がそれを取り出して利用しようと考えなかったのは無理もありません。分析化学的センスを持っていたC. E. Gleit やJ. R. Hollahan に至ってようやく低温プラズマの化学的応用が開けたと言えます。
3-1.プラズマ化学装置
低温プラズマを作るには低圧気体に電場を与えて電子を高速に走らせなければなりませんが,古くは陰極と陽極をガラス管に封入して放電させました。その後電磁場をガラス管の外部から与えて放電できるようになり,プラズマ化学の方法が展開しました。外部からの電磁場としては直流を用いることができないので,交流,特に高周波を負荷するのが有効で,一般的には13.56 MHzの工業周波数を利用します.もっと低周波や高周波を用いることもありますが,プラズマ化学反応の本質を変えるわけでもないので,許可された13.56 MHzを利用するのが結局一番便利です。初期はガラス管にコイルを巻いて同調回路を形成し,同軸ケーブルで高周波電源に繋いでいましたが,近年は反応管が太くなってコイルで巻けないので,図6のように2枚の電極板を反応管に対極として取り付け,同調回路の両端から高周波電力を加える方式が多くなっています。高周波電力は1チャンバーあたり300 Wまでですが,反対にあまり電力を絞るとプラズマが消えてしまいます。ガラス管にコイルを巻く方式を誘導負荷,チャンバーに電極板を取り付ける方式を容量負荷といいますが,出来上がった気体のプラズマ状態は同じです。


図6 容量負荷方式プラズマ装置
プラズマ装置の真空系はあまり高度のものを要求しません.プラズマチャンバーに気体を供給しながら出口からポンプで引いているので,大体1 Torrから0.1 Torrあたりになるよう調節します。ポンプの性能としては到達真空度より吸引速度のほうが大切で,チャンバーの大きさにもよりますが,規格値で100 L/minから300 L/minあたりのものを使用します。大抵ピラニーゲージを備えていますので,圧力の目盛りを読みながら気体の供給量をニードルバルブで調節します。プラズマが発生すると気体はグロー放電で発光しますが,酸素では僅かな赤み,窒素やアルゴンは濃いピンク色,水素やヘリウムは青白色など気体によって異なります。
調理用の電子レンジはマグネトロンから放射されるマイクロウエーブで水分を加熱しますが,2450 MHzの高周波電力ですから低圧気体に負荷するとプラズマが発生します。500~1000 Wの出力が簡単に出ますので大型のプラズマ装置に使われることがあります。ただ光に似て直進するのでプラズマの均一性が乏しく,このため電子レンジではターンテーブルを回転して加熱効果が一箇所に集中しないよう工夫しています.生産工場のプラズマ化学装置では供給気体の上流でマイクロウエーブを負荷し,出来た活性種を下流で目的物に接触させる例が工業材料やプラスチックフィルムの表面処理に見られます。
4-1.プラズマ化学反応
プラズマ化学で最初に実用された有機物の灰化では,酸素がプラズマ化されて出来た原子状酸素が反応を進めました.加速電子e-Δによって酸素分子の原子間結合が切れ,極めて不安定なラジカル種の原子状酸素O*を生じます7, 8)。
O2+e-Δ→O*+O*+e-(*はラジカル性活性種)
原子状酸素は放置すれば二個が再結合して元の酸素に戻りますが,もしプラズマ空間に有機物の材料RHがあると炭素と水素の結合から水素を引き抜き,同時にC-C結合への割り込みによってアルキル鎖の切断を行います。
RH+O*→R*+OH*
R‘-R”+O*→R‘*+R”O*
生成するラジカル種は引き続き分子状酸素や原子状酸素と反応し,過酸化物を形成しますが,いずれも発熱反応で間もなく低分子化されて気相に放出され,最終的に二酸化炭素と水になってプラズマ反応器を出てゆきます。実際反応器の出口でガスを採集し,質量分析器にかけても検出されるのは二酸化炭素と水ばかりで,試料の付近から採集したガスからm/e = 30のホルムアルデヒドが僅かに検出されただけでした。このようにして原子状酸素は材料表面で殆ど完全酸化を達成していることが分かりました。
紙や木は空気中でも安定ですが,最初に点火するとその場の熱でC-HやC-C結合が切れ,原子状水素やアルキルラジカルが生成します。
RH+熱→R*+H*
R‘-R”+熱→R‘ *+R”*
生じた原子状水素やアルキルラジカルには酸素分子が働き酸化が進みます。
R*+O2→ROO*
H*+O2→HOO*
これらは発熱反応なので連鎖的に周辺に広がり,過酸化物は不安定で急速に断片化し,最後は二酸化炭素や水になって燃焼が進行します。このように空気中では有機材料を高温にしないと反応は進行しませんので,灰化中に材料のタール化や破裂など破壊的な力が加わったり,同時に高温による無機成分の揮散があり,残留灰分から原材料中の無機質の分布や存在量を解析することが困難になります。
プラズマ灰化の利点は材料を加熱しなくても表面から静かに有機質を酸化除去できることです.それでも発熱反応ですから,材料は室温より高くなります。赤外輻射温度計で表面温度を測るとプラズマ電力にもよりますが,100~130℃あたりを示します。酸素プラズマによる有機化合物の燃焼速度は化学構造によっていろいろですが,表1に揮発性の低い脂肪酸と芳香族カルボン酸を中心に糖や高分子物質を加えて比較しました9)。糖や低分子の脂肪酸は似たような減量速度ですが,酸無水物は激しく減量しました.これは分子間結合が弱くて昇華性があるためと思われます。ステアリン酸など長鎖脂肪酸はむしろ増量していますが,これは融点が低くプラズ マ酸化が始まるとすぐ液化しますので,表面で酸化された油が内部に拡散し,未反応の油が表面更新を行うからと解釈されました。もちろん酸化が進んで表面更新が終わると減量が始まります。ポリ塩化ビニルやテフロンなど水素原子が表に出ないか,もともと無いものは殆ど減量がありません。プラズマ酸化の引き金である原子状酸素による水素引き抜きが起こらないことで理解できます。

表1 有機化合物の燃焼速度
プラズマ化学反応は最初に酸素プラズマの強力な酸化作用から知られるようになりましたが,たまたま半導体集積回路の製造工程で,シリコン基板のエッチング(彫り込み)に気体のフレオン(CF4)から発生する原子状フッ素を利用できないか試みられました。同じ装置で気体が変るだけですから,この技術転回は容易であったと思われます。それまではフッ化水素溶液に基板を浸漬して回路をエッチングする湿式法を用いていましたが,出来上がった回路の断線事故が多く,また回路の密度が上げられない欠点がありました.フレオンプラズマを用いる乾式法によって一挙に断線事故を無くし,同時に高密度の回路素子を造ることに成功しました。フレオンをプラズマ化すると原子状フッ素 F*のほか解離物が得られますが,シリコン基板と反応して気体の四フッ化ケイ素を生じ,空間に放出されます。
Si+4F*→SiF4
SiO2+4F*→SiF4+O2
コンピュータや電子機器の記憶素子や論理回路には膨大な数のトランジスタやダイオードがシリコン基板の上に構成されていますが,これらは総てプラズマ化学技術で製造されています。酸素プラズマの応用から始まって,短期間でフレオンを用いるシリコンエッチングに拡大したプラズマ技術は,まさに現代のIT社会にとって大切な支持基盤と言えましょう。さらに冒頭にも述べましたが,プラズマ技術は無機ガスに限らず,有機ガスをプラズマ化して高分子の薄膜を固体材料の上に形成させる「プラズマ重合」にも発展しました。逆浸透膜による淡水化やイオンの選択透過膜など未来志向の研究がいろいろ行われています。シリコン技術や膜透過技術についてはそれぞれで大きな学術領域が育っていますが,これらについては別の機会に改めて説明したいと思っています。
5-1.食品および生体試料の灰化
原子吸光分析法が普及してから食品や生体に取り込まれた重金属の分析が盛んになりましたが,試料をるつぼなどに入れ高温で灰化すると,目的元素の揮発や灰の飛散によって損失が生じます。このため濃硝酸と塩酸,過塩素酸からなる分解液で加熱処理し,有機の抽出試薬で目的元素を転溶した上,原子吸光分析装置に送りました。この湿式分解法は成分の回収率はよいのですが,分解中腐食性ガスが出ることや分解液から目的元素の溶媒抽出の手間がかかります。低温灰化法では目的元素の損失が少なく,かつクリーンな方法と考えられますが,ビスケットなどデンプン食品をるつぼ灰化法と低温灰化法で処理し,薄い塩酸に溶解して重金属の測定をした例を表2に示します10)。この数値は湿式分解法の結果を100%とした値ですが,元素によって違いはあるものの,全体的に低温灰化法のほうが回収率は優れていることが分かります。
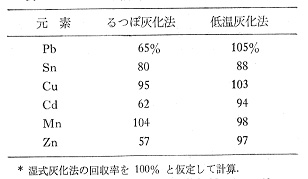
表2 デンプン食品中の重金属の回収率
放射性同位元素をトレーサーとする生体の代謝や環境汚染経路の探索が行われますが,トレーサーの濃度が極めて低いので試料を灰にして濃縮する必要があります。その灰の中から放射性物質の回収率を調べた例があります。実験には血液1 mlをボートにとり,トレーサーを一定量加え,100℃で低温灰化しました.灰をシンチレーションカウンターで測った結果を表3に示しました1)。比較のため電気炉で灰化したときの数値を挙げています.低温灰化法でも金,銀,水銀,ヨウ素でボートから逃散があり,後流のトラップで捕捉されていますが,電気炉法に比べはるかに回収率がよいことが分かります。

表3 血液中の放射性同位元素の回収率
工場における粉塵や煙道排ガスは従業員や近在住民の環境管理の対象になっていますが,環境空気の高流量のサンプリングではガラス繊維フイルターを,低流量のものではメンブランフィルターで試料採取を行います。図7ではガラス繊維フイルターで採取したものを高温灰化および低温灰化した後,塩酸と過酸化水素で金属元素を抽出して原子吸光にかけた結果を示しました11)。ここでは高温灰化のデータを100として低温灰化の回収率を比較していますが,鉛,カドミウム,マグネシウムなどで低温灰化のほうがかなり高い値を示しています。
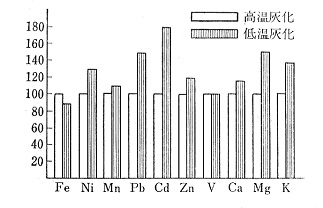
図7 粉塵試料の金属元素回収率
高分子材料にはいろいろな無機添加物が含まれ機能性を高めていますが,無機質の量が多いときは材料をそのままX線回折装置にかけ,ピークの回折角からある程度その化学物質が特定できます。しかし含量が少ないと丘形に盛り上がった有機質のハロー図形の中に無機質のピークが埋没してしまい,成分の解析が困難になります。高分子材料を低温灰化法で処理すると有機質は除去され,無機質は原材料中の状態のまま残留しますから,X線回折図で細かい結晶形の違いが全部分かります。エチレン-プロピレンゴムで出来たパッキング用バルブシートについて灰化処理の前後で撮ったX線回折図を図8に示しました12)。Aは灰化前で酸化亜鉛のピークのみが見られますが,Bの灰化後はハロー図形が消え,他の微量物の回折線が現れています。これからこの材料中には主成分の酸化亜鉛のほか,タルクMg3SiO10(OH)2と緑泥石が存在することが分かりました。高温灰化法を用いると無機質は相転移や脱水,酸化などで結晶形が変化し,X線回折図に誤った情報を与えます。
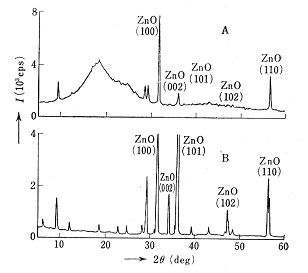
図8 パッキング用バルブシート中の無機物のX線回折図
低温灰化法は材料の表面からゆっくりと酸化除去するものですから,迅速燃焼を期待することは本来出来ません。そうは言っても処理時間を不必要に長引かせることも得策ではないので,低温灰化の長所を失わない程度に迅速処理を試みるべきです。第一には試料の表面積を広げることで,固体試料は破砕,粉砕してなるべく底の広いボートに均一に入れます。試料にもよりますが,2~3 mmの厚さの層に広げるとそのままで全部が灰化します。柔軟な固体試料はフレーク状に削るとよいのですが,あまり薄いと灰が帯電して飛散する危険もあります。次に高周波電力を大きくすると原子状酸素の密度が上がり,燃焼速度は上がりますが,反応熱も蓄積して低温灰化のメリットが次第に失われます。既述の赤外輻射温度計で試料温度を測定することも出来ますが,割合高価な機械ですから,ショ糖をモニタリングに用いると便利です。ショ糖を少量ガラスボートにいれ,試料と並べて灰化すると140~150℃で割合敏感に褐色を帯びますから,無色のまま灰化できる高周波電力に設定することが出来ます。灰化が困難で芯が残るような試料は時々かき混ぜが必要です。それは緻密な灰の層を表面に形成する場合ですが,灰が原子状酸素の再結合触媒として働き,表面で原子状酸素を失活させるからと考えられます。多少面倒ですが数時間後にプラズマ装置を停止して試料ボートを取り出し,細いガラス棒でかき混ぜ,未反応の芯を表面に出す必要があります。
6-1.電子顕微鏡による観察
酸素プラズマを用いる低温灰化の利点は非破壊的な有機質の除去ですから,植物や動物組織の中の無機質分布をそのまま灰に残すことが出来ます.骨や歯のように独立した無機質ばかりでなく,組織の構成分となって分布しているものも灰の残像から観察が可能です.灰の造形を最初に光学顕微鏡で観察したのは1833年フランスの植物学者F. V. Raspailですが,タマネギの薄皮をガラス板上に貼り付け,ゆっくりと火にかざして灰化し,細胞膜の無機像を観察しました.その後電子顕微鏡が開発されて灰の微細構造を見ようとすると,高温灰化ではディテールが失われて観察が不十分でしたが,ようやく1964年ごろよりR. S. Thomas(図9)によって低温灰化法が採用され,電子顕微鏡の観察に耐える写真が得られて画期的な成功を収めました。超薄切片の技術の向上と共に,細胞,細菌,ウイルスまで組織内の無機質分布が観察できるようになりました。

図9 Dr.R. S. Thomas
透過電子顕微鏡の観察では,細菌や超薄切片を支持する膜を作るため,プラズマ処理で消失しない一酸化ケイ素が選ばれました。始めにコロジオンの膜を水に浮かべ,細かい金網で下からすくい,その上に蒸着法で20~30 nmの一酸化ケイ素膜を付けました。細菌や組織切片をその上にのせ,低温灰化装置で処理します。コロジオン膜は消失し,一酸化ケイ素膜の上に試料の灰化物が残ります。一酸化ケイ素膜は電子線を透過しますので,灰化物の電子顕微鏡像が撮影できます。デリケートな造形を残すためにはプラズマ電力を小さくし,できれば放電域の下流で灰化するのが適当です。灰化終了後は灰の造形を壊さないよう,時間をかけてチャンバー内を常圧に戻すことが必要です。
Thomasは最初に巨大桿菌のB. Megateriumの胞子を灰化し,内部の核とこれを包む皮膜を観察しました(図10-左)。また同じ胞子を樹脂で固め,ミクロトームで薄片にしたものを灰化して中央断面の無機像を得ました(図10-右)4)。驚くべきことは胞子を包む膜が二重になっていたことで,灰化によって分離し,内側は斜めに倒れています。この倒れた部分では条痕が見られ,恐らく膜の強化構造に寄与しているものと思われます。内部の楕円形は核のあった部分ですが,灰化によってDNAのリン酸が残り,空気中の湿気を吸って粘液化したものではないかと想像されます。

図10 B.Megatherium :胞子
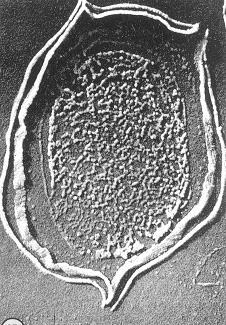
図10(同) B.Megatherium :60nm切片
1950年代に走査電子顕微鏡が開発され,試料の調製が楽な点と三次元像が観察できることから,急速に普及してきました.Thomasらはイネのもみ殻の灰化像で立体的な微細構造を記録しました(図11)5)。灰化物は殆どケイ酸ですが,まずグラファイトを蒸着し,ついで金を蒸着して25kVの電子線で撮影しました。Aはもみ殻の灰化物ですが,囲みの中をさらに拡大するとBのように強固な外皮が存在し,その中に薄い内皮がカーリングした状態で見られました。Bの囲みの部分をさらに強拡大するとCのようになり,円筒型のかご状の骨格が観察されます。米一粒の中にこれほど複雑な構造を作っているとは,自然界の創造力と神秘さを改めて感じさせます。走査電子顕微鏡は試料表面に金の蒸着膜を付けて二次電子を放出させますが,銀染色を施した試料の灰化物から染色部位を検出することができます。図12は小脳皮質にあるプルキニエ細胞(Purkinje cell)の切片を硝酸銀液で処理し,神経細胞に特異的に銀イオンを結合させた試料ですが,Aはそのまま光学顕微鏡で観察したもの,Bは同じ物を灰化して走査電子顕微鏡で見たものです13)。灰化前は銀の定着で細胞が黒く見えますが,灰化後は銀から発する二次電子で白黒が反転し,神経細胞が白く浮き上がっています。その他にも左下部にある顆粒細胞や右上部にあるかご状神経索が鮮明に認められます。神経細胞は重金属と結合し易いので,水銀やカドミウムなど重金属汚染と神経障害の関連についても低温灰化法が解明に寄与できるかも知れません。
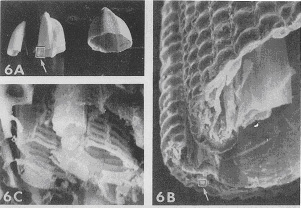
図11 もみ殻の灰化物
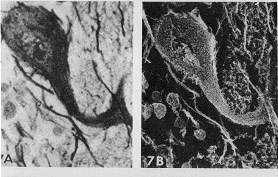
図12 脳細胞の銀染色と灰化像
6-2.光学顕微鏡による観察
低温灰化法の特長は有機質を除去して隠れた無機質を浮き上がらせることですが,1965年米国のC. Berkleyらは珪肺やアスベスト肺の診断に利用できないかを検討しました14)。組織の断片を取り出して顕微鏡で見ても珪酸体やアスベスト繊維は周囲の組織に埋もれていて全く観察できません。特にアスベスト繊維は空中に浮遊するので,アスベスト工場内だけでなく,周辺住民の健康障害にもなっていて重大な社会問題になっています。その他都市部では道路を走る自動車のブレーキから,作動ごとにアスベストが飛散し,健康人でも実際には相当アスベストの蓄積があると考えられます。図13はアスベスト肺の灰化像の例を示しますが,他の無定形灰分との区別がつき難いので,位相差顕微鏡を使用し結晶体として判定しました。直線状のアスベスト繊維が組織全体に多数見られます。中には繊維の周囲を包絡物が巻いたものがあり,灰化後は褐色をしているので,恐らく鉄を含むタンパク質が異物と認識して形成したのではないかと推測されました。
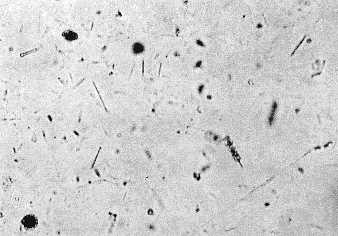
図13 アスベスト肺の切片灰化像
植物体の中にはシュウ酸カルシウムやケイ酸体が含まれていて,組織の中での分布に独特のパターンを示すことが古くから知られていました。1920年オーストリアのH. Molischがすでに多数の植物の葉や組織の灰化像を整理して,植物の分類や鑑識に役立てています。漢方薬として流通する生薬には高価なものがあり,そのため偽物や混ぜ物が横行しますが,それらの管理に実際に使われました。方法としてはスライドガラスの上に試料を置き,下からガスバーナーでゆっくりと加熱して灰にしますが,灰化の途中で灰の構造が壊れ易く,またシュウ酸カルシウムが熱分解して膨れ上がるなどいろいろな障害がありました。そこで筆者の研究室では低温灰化法を導入してこれらの結晶体を原形のまま残す方法を検討しました。
葉はそのまま灰化の試料になりますが,灰化中にカーリングして巻き上がることもあるので,コロジオン液で試料を貼り付けます。最初から曲がったものは図14のようにセロテープで固定します。プラズマ装置はなるべく小電力で操作しますが,放電域の中心よりは下流域のほうが緩和に灰化できます。灰化を終わった試料はチャンバーから出し,カナダバルサムのキシレン溶液(2:3)を灰の横から沁み込ませ,灰を固定します。カバーガラスをかけ二三日放置すると,キシレンは蒸発して永久プレパラートになります.無定形の細かい灰分はバルサムの中でバックグラウンドになりますが,結晶体は光学顕微鏡で鮮明に観察できます。偏光顕微鏡を用いれば結晶形や複屈折による干渉縞などが美しく見られます。
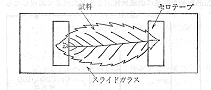
図14 葉の固定
図15はツバキの葉の低温灰化像と高温灰化像を比較したものですが,左の低温灰化像ではダイヤモンド状の透明なシュウ酸カルシウムが見られ,偏光顕微鏡観察では虹色に美しく輝きます。これに比べると右の高温灰化像は結晶形が失われ,恐らく熱で炭酸カルシウムや酸化カルシウムとなって膨らんでいます15)。シュウ酸カルシウムは厳密に言えば無機物とは言えませんが,低温灰化法ではカルシウム原子が結晶表面をガードして内部に酸素プラズマを及ばせないのではないかと思われます。これに比べると高温灰化法では内部からシュウ酸基が分解して壊れ,結晶形が破壊されるものと想像されます。
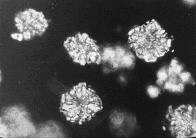
図15 ツバキの葉の灰化像:左低温灰化法
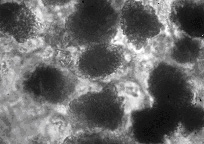
図15(同) ツバキの葉の灰化像:右高温灰化法
葉の中にあるシュウ酸カルシウムの結晶は,低温灰化によって化学的に変化していないと想像されますが,灰のX線解析によってそれが証明されました。図16はシュウ酸カルシウム結晶を多量含むイチョウの葉の低温灰化物を集め,X線回折パターンを記録したものです16)。灰化物にはシュウ酸カルシウム以外の無機物もあるので,あまり細かいピークの特定は出来ませんが,同時に標準のシュウ酸カルシウム1水物Ca(COO)2-H2Oと比べると主要ピークが完全に一致し,低温灰化中脱水せずに残存することが分かりました.
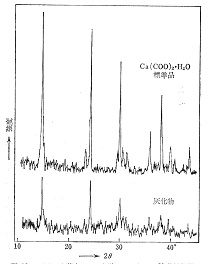
図16 イチョウ灰化物のX線回折像
植物組織の中に生産される結晶体にはシュウ酸カルシウムの他,炭酸カルシウムやケイ酸体があります。イネ科植物には米,麦など穀物の他,竹も同類でケイ酸体を大量に含んでいます.主として葉脈に沿って配列しているので,ケイ酸体の形や配列の模様が分類や種類の判別に利用できます。ケイ酸体は高温にも耐える物質ですから,低温灰化法のメリットはあまり無いように思われますが,それでも灰が崩れないのでケイ酸体の配列や分布が容易に観察できます。図17の左はハチクの主脈にあるケイ酸体で,丸みを帯びた四角い形のものが数列あり,どちらかと言えば葉脈の方向に長いものが多く見られます。右はモウソウチクですがケイ酸体は正方形に近く,やはり葉脈に沿って並んでいます17)。両者に共通する特徴はケイ酸体のどれにも黒っぽい核点が見られることで,その由来は分かっていません。ケイ酸体の化学組成を知るため,灰化物を塩酸で洗浄しケイ酸体だけを集め,X線回折で解析したところ無水ケイ酸に一致しました。ただし殆どが無晶質の石英で,一部に結晶性の石英を含んでいることが判明しました。常温の環境でケイ酸イオンを根から取り込んで,体内で脱水して無水ケイ酸を生産する植物のメカニズムについては全く不思議と言うより他ありません。
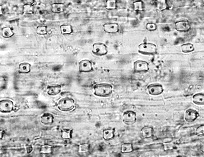
図17 灰化像:ハチク
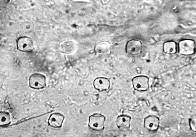
図17(同) 灰化像:モウソウチク
7-1.おわりに
プラズマ化学は新しく仲間入りした化学の方法ですが,1960年代に始まって以来,分析化学,半導体,薄膜技術の領域で大きな成果を挙げています。低圧気体の放電で出来るプラズマの発光はかなり歴史があり,照明用として電気工学の重要なレパートリでしたが,放電空間での気体の化学的側面にはあまり気がつかず,長い間見過ごされてきました。酸素の低圧放電の空間で有機物を除去できると言うC. E. Gleitの論文が1962年分析化学の雑誌に掲載されたのは驚きでしたが,化学者にとってはよく理屈の分からない電気装置で,半信半疑のまま暫く様子を見る状態が続きました。しかし間もなくJ. R. Hollahanの解説記事が出てようやく化学者にも利用できる技術と分かりました。有機元素分析の分野でも試料中の灰分の定量は重要な項目で,主としてボートやルツボに試料を入れ,バーナーや電気炉で加熱する方法がとられていましたが,高温に曝すので残留する灰の中の成分の回収が悪い欠点がありました。酸素の低圧放電で熱を伴わずに有機物を灰化できることは大きな魅力でしたが,一方どういうメカニズムで低温灰化が進むのかという原理的な興味も湧き起こってきました。
応用と原理の両面でかなり急速に研究が進み,1970年代には関連学会も複数立ち上げられてプラズマ化学も大いに活況を呈しました。半導体集積回路のためのフレオンエッチング技術はプラズマ化学の大規模な成果ですが,方法論としては酸素プラズマによる有機物の灰化技術から派生したもので,分析化学分野の最初の貢献は記憶されるべきでしょう。有機ガスを用いたプラズマ重合も薄膜の作成に利用され,イオンや分子の選択透過膜や材料表面の親水化や疎水化に有効に利用されています。目的によってプラズマ装置の構造や規模はいろいろですが,働いている化学の基本は似ていて,共通の理解が可能です。
本稿ではプラズマ化学の出発点であった酸素プラズマについて,原子状酸素の発生から有機物の低温燃焼機構を概略説明しました。火を用いる燃焼は石器時代から続いていますが,熱を出さずに燃焼する新しいプラズマ灰化法は歴史を塗り替えるものと言えます。この方法で有機質に埋もれていた無機質の構造を明らかにすることが出来ました。生物組織の微細構造を保存して電子顕微鏡の観察に耐える灰化像をもたらしたのは,この方法がいかに緩和に完全酸化を遂行させているかを物語っています。大きな可能性を秘めたプラズマ化学の技術は,さらに多方面で発展の道を辿っています。
8-1.参考文献
1)C.E.Gleit,W.D.Holland,:Anal.Chem.,34,1454(1962).
2)J.R.Hollahan:J.Chem.Educ.,43,A401(1966).
3)F.K.McTaggart:”Plasma Chemistry in Electrical Discharges”,Elsevier,Amsterdam(1967).
4)R.S.Thomas:J.CellBiol.,23,113,125(1964).
5)R.S.Thomas,F.T.Jones:”Proc.28th Ann.Meeting,Electron Microscopy Soc.of America”,p276,ClaitorsPubl.Div.,BatonRouge(1970).
6)J.R.Hollahan,A.T.Bell:”Techniquesand Applications of Plasma Chemistry”,JohnWiley,NewYork(1974).
7)穂積啓一郎: 化学の領域,25,713(1971).
8)穂積啓一郎編: ”低温プラズマ化学”,化学の領域増刊 111号,南江堂 (1976).
9)穂積啓一郎,松本 守: 分析化学,21,206(1972).
10)辻 理,陣内新平: 食品機械装置,1973,No.9,p18.
11)及川紀久雄: ”重金属の分析”,講談社サイエンティフィックシリーズ,p111(1971).
12)鹿内 聡:”X線分析の進歩”,5,73科学技術社(1973).
13)E.R.Lewis:”Scanning Electron Microscopy”,p111,IITResearchInst.,Chicago(1971).
14)C.Berkley,J.Churg,I.J.Selikoff:,W.E.Smith:Ann.NewYork Acad.Sci.,132,48(1965).
15)梅本光一郎,穂積啓一郎: 薬学雑誌,91,828(1971).
16)K.Umemoto,K.Hozumi:Microchem.J.,17,689(1972).
17)K.Hozumi,M.Hutoh,K.Umemoto:Microchem.J.,17,137(1972).

