

TOPICS
CHNフォーラム
第六部 イオンセンサーの応用
- 1-1.はじめに
- 2-1.電極の電位
- 3-1.電位差の測定
- 4-1.pHの測定
- 5-1.イオン選択性電極
- 6-1.固体膜電極
- 7-1.液膜電極
- 8-1.直接電位差法
- 8-2.電位差滴定
- 8-3.自動電位差滴定装置のアクセサリー
- 9-1.おわりに
- 10-1.参考文献
- 関連装置
1-1.はじめに
溶液の中のイオン種の濃度を知るのに,電極を挿入して応答信号を測定することは,目的物を分離したり発色させたりする必要がないので便利な方法です。測定対象も水素イオンやハロゲンイオンなど古いものから,近年は各種のイオン選択性電極が開発され,分析化学の領域で広く活用されています。また電極の応答信号は本来微弱なものですが,電子技術の進歩で増幅,演算,記録など情報処理の面でも大きな変革がありました。
イオンの定義は中性の原子や分子から電子が失われて陽イオンになるか,または電子が付着して陰イオンになったものですが,陰極や陽極に引かれて動くことからギリシャ語のion(移動)の名が付けられました.イオンには+や-の電荷があって不安定なものですから,水中では水分子に取り囲まれて水和イオンとして安定化しています.食塩を水に溶かすとナトリウムイオンと塩素イオンに解離し,それぞれは水和イオンとして独立して行動していますが,これを煮詰めて水を蒸発させると水和ができなくなり,ナトリウムイオンと塩素イオンは結合してもとの食塩結晶として析出します。水の中でしか存在しないイオン種は,1887年スエーデンのアレニウス(S. A. Arrhenius, 1859~1927)により電解質論として予言されましたが1),その後多くの化学者によって実証され,1903年ノーベル化学賞を受けました。
電荷をもったイオン種は,溶液に挿入した金属電極やいろいろな伝導性材料と電気化学反応を行い,電荷のやりとりをしますが,結果として電極内の電子が余ったり不足したりすることを測定すると,溶液中のイオンの濃度が知り得ます。水素イオンはガラス電極によって,銀イオンは銀電極によって正確に測定がされます。
陰陽のイオンを含む電解質溶液に異なる金属片を差し込むと金属片の間に電位差(電圧)を生じることは,イタリーのガルバニ(L. Galvani, 1737~1798)によって有名な蛙の実験(図1)から発見されました。最初は蛙の筋肉が生体電気を作ると考えたのですが,間もなくボルタ(A. Volta, 1745~1827)によって異なる材料の金属片が蛙の体液に接してそれぞれ異なる電位を示し,これを繋ぐと回路に電流が流れて筋肉が収縮すると説明しました.ボルタは1800年,硫酸の液に銅板と亜鉛板を入れ,1.1ボルトの電池を作り,これが世界最初の電池となりました(図2)。電位差の単位のボルトも彼の名前から来ています。
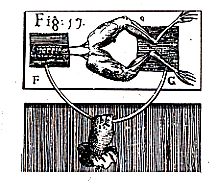
図1.ガルバにの蛙筋肉の実験
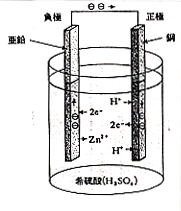
図2.ボルタ電池の構成
電池は乾電池の形でわれわれの生活に多く使われていますが,使用と共に陽極と陰極の電位差が小さくなり,間もなく電流を流さなくなります。それは電極と電解質の間で化学反応を起こす活性物質が減ってしまっているからで,いわば電位差は活性物質の濃度の指標と言うことになります。試料溶液に電極を差し込んで電池を形成させ,その電位差から試料溶液中の目的イオンの濃度を検知したり,試料溶液に反応性物質を加え電位差の変化を記録する滴定などいろいろな分析技術がこれから生まれました.広大な応用分野がありますが,このうち微量分析に関係のある方法について記述します。
2-1.電極の電位
物体の電位は電気学で難しい定義がされていますが,平たくいえば地球(アース)に対して何ボルトの電位差を持っているかということで,動かない基準がありますから知ろうと思えば計ることが出来ます。しかし実際に電流や電位差を測る時は実験台の上にある二本の電極の間で行いますので,それぞれの電極の絶対電位は分からなくても,電位の差が分かればよいので,電池を形成して測定を行う電気化学分析はもっぱら二本の電極間の電位差か両極を結んで流れる電流を測定することになります。
図2のボルタ電池では亜鉛電極が硫酸液に入っていますが,亜鉛はイオン化傾向が強いので金属表面からZn2+が溶け出し,電極内に電子が残されます。もともと中性の亜鉛に余分の電子が貯まるので電極電位は負の方向に動きます。一方銅電極はイオン化傾向が小さいので溶けませんが,硫酸の水素イオンによって電子が抜き取られ,水素分子となるので,電極電位は正の方向に移ります。化学反応で示すと,
Zn極: Zn = Zn2+ + 2e–
Cu極: 2H+ + 2e– = H2
亜鉛は陰極になり,銅は陽極になりますが,陽極の表面は次第に水素に覆われ,間もなく下の反応が起こり難くなります.電池としてはすこぶる寿命が短いので,あまり役に立ちませんでしたが,そのうち反応が持続的に起こる電池が考案され,ダニエル電池やマンガン電池となって実用化されました。
電池は二本の電極で構成されていますが,両極間の電位差(起電力)は電圧計で測定できても,それぞれの極の電位はこのままでは分かりません。代数計算でA-B = Cのとき,Cを知ってもAやBは不明というのと同じです。このような時,便宜的にでもA電極の電位を知ろうと思えば,B電極にゼロボルトと約束したものを選べばよいので,このときの電位差はそのまま未知電極の電位になります。実際ゼロボルトの電極は協定により水素ガスを白金板に吸着させて1 mol/lの塩酸溶液に入れたものと決められています2),3-p236)。(図3)
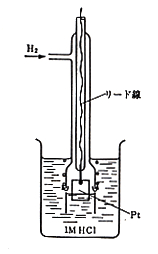
図3.標準水素電極
水素電極は電極電位の基準として大切なものですが,実際には水素ガスを扱うので危険もあり,持ち運びも大変です。そこで考えられたのが銀―塩化銀電極で,図4のような構成になっており,多孔板を介して試料液に接しますが,電極の電位は内部の塩化カリウム溶液で一定に保たれています3-p243)。この電極電位は25℃で+0.222ボルトを示します。従って銀―塩化銀電極を基準として,ある感応電極との電位差がEボルトであれば,この感応電極の電位はE + 0.222ボルトになります。もちろんEは+の時と-の時とがあります。水素電極は協定による究極のゼロ電位と決められていますが,手軽さにおいて銀―塩化銀電極が優れており,実用の参照電極として広く使用されています。
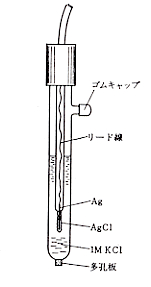
図4.銀ー塩化銀電極
参照電極の電位は固定されているので,これと感応電極を組み合わせた電池の起電力はイオン溶液の濃度によって変化します。この変化はネルンスト式Nernstian equation3-p235) と呼ばれる濃度の対数で示されるので,多少厄介な点がありますが,その代わり滴定などが極めて精密に行える利点があります。亜鉛電極が亜鉛イオンを含む溶液に入っていると,電極の電位は,
E = E0+0.059/2 log[Zn2+] ボルト
で動きます。0.059/2はネルンスト勾配と言われる比例定数ですが,亜鉛イオンが2価で電子2個をやり取りするので2で割っています。亜鉛イオン濃度が1 mol/lのときは対数項がゼロになり,その時の電極電位はE =E0で,これを亜鉛イオンの標準電位と言っていますが,これより濃度が小さくなると対数項は負の値をとり,電極電位は下がります。対数に比例するので,10-1,10-2,10-3と一桁変わる毎に0.059/2ボルトづつ電位が低下しますが,この様子は図5に上下反転して示されています。
電極電位を知るとイオン溶液の濃度が分かります。いろいろなイオンに感応する電極があり,その電位を精密に読み取って濃度を測定することができます。また滴定では試薬を徐徐に加えると等量点で感応イオンが突然消滅したり,逆に出現したりするので大きな電位飛躍があり,ここを捕らえて精確な定量を行っています。
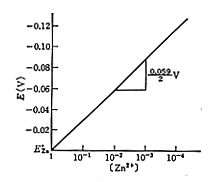
図5.亜鉛電極のネルンスト応答
3-1.電位差の測定
電池の電位差は電圧計を用いて測れますが,普通の電圧計では測定のために僅かな電流が流れるので,平衡状態にあった電極電位が変化します。そこで電流を全く流さない電位差計が必要です。古くは特殊な真空管を用いましたが,現在は電界効果型トランジスタで簡便に測定が出来るようになりました。電位差計の測定精度はいろいろありますが,微量分析ではデジタル式で±0.1 mVのものが必要です。さらに精密なものとしては,ポテンショメータを使った手動のもので±0.05 mVというのがありますが,これは研究用のもので一般向きではありません。
電池の電位差を測るときはある決まりがあります。電池式をまず書いて,左の電極を基準に右の電極の電位を測定します。例えば電池式が,
銀-塩化銀参照電極∥試料溶液(Zn2+)|Zn
のとき,左の電極を電位差計の参照電極端子(アース側)に繋ぎ,右の電極を測定端子に繋ぎます。∥の表示は参照電極の内部液と外部の試料液が混ざり合わずに接していることを表していますが,|の表示は電極材料が直接試料液と接していることを意味します。電池式を左右反対に書くと電位差の符号も正負反対になります。この取り決めは1953年のIUPAC17回大会でストックホルム規約Stockholm conventionとして承認されました4)。電池の起電力には本来正負の符号はないのですが,符号をつけておかないと2個以上繋いだときに総合起電力がいくらになるのか問題になるので,電池式で確定しています。
酸,塩基の濃度を測るガラス電極pH計はどこの化学実験室にもありますが,本体は電位差計で,スイッチ切り替えによりpH計モードと電位差計モードと両方の使い方ができます。pH計の測定精度は日本薬局方で±0.05 pH以下としていますが,微量分析では±0.02 pHくらいのものが必要です。ただしこの精度はあまり強い酸性,塩基性の溶液では通用しません。
4-1.pHの測定
水素イオンに応答するガラス電極はイオンセンサーのはしりと言ってよく,1906年イギリスのクレーマー(M. Cremer)よって考案されました。次いで1909年デンマークのセーレンセン(S. Sφrensen)は,生体の体液で微妙な酸,塩基の調節が行われていることに気づき,水素イオン濃度の精密測定の研究を始めました5)。
物理化学ではすでに水の解離が測定されていて,
H2O ⇆ H+ + OH-
中性の水の水素イオン濃度が10-7 mol/lであるところから,
[H+] = [HO–] = 10-7
となります。水のイオン積は [H+][OH–] = 10-14で一定ですから,[H+]が増えれば[OH-]が減少します。両辺対数を取って見ると,
log[H+] + log[OH–] = -14
セーレンセンは水素イオンの濃度で酸,塩基の強度を表すために,
pH = -log[H+]
としました。対数項に負の符号がついているのは, [H+] が普通1 mol/l以下で対数が負になりますから,前に負の符号をつけて正の値に反転しています。この表示法によって [H+] = 1mol/lのときpH 0, 中性のとき [H+]=10-7 mol/lですからpH 7, また[OH–] = 1mol/lのとき理論上 [H+] = 10-14ですからpH14となります.pH計には0から14までの目盛りが刻んであります。
ガラスが水素イオンに応答するのは多少偶然が幸いしています。理化学用ガラスは当時ソーダガラスであって,ケイ酸網目の中にところどころSiO-Naのイオン結合性末端が含まれています。図6にはナトリウムを含まない石英ガラスとの違いを示しました。ただしケイ素は4個の酸素原子と立体的に結合するところ,図では3個の酸素と平面的に結合しているように描いています。
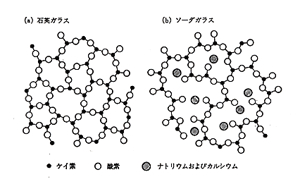
図6.ケイ酸ガラスの網目構造
ソーダガラスを水に浸漬するとガラス表面からナトリウムイオンが溶け出し,代わりに水素イオンが入ってケイ酸基SiO-Hの層で覆われます。溶液に[H+]が多いとガラス表面は電気的に中性のSiO-Hに留まっていますが,[H+]が少なくなるとガラス表面は水素イオンが水中に抜け出し,SiO-となってガラス表面の電位を負の方向に引き下げます。化学式で書くと,
SiO-H ⇆ SiO– + H+
ガラスの電位もネルンスト式に従いますが,1価イオンですから,
E = E0+0.059log[H+] ボルト
となります。ここでpH =-log [H+]ですから,pHが1大きくなるとガラスの電位は0.059 V下がります。この電気化学反応はソーダガラスでないとうまく進みませんが,現在の理化学用ガラスはパイレックスガラスになっているので,クレーマーは古いガラスの時代に実験をして得をしたことになります。
ガラスを電極に仕立てるのは銅や亜鉛電極のように簡単ではありません。このためガラス電極は図7のようにガラス管の一端に薄膜の球を作り,この中に0.1 mol/lの塩酸を封じ込み,さらに銀―塩化銀の参照電極を挿入します3-p251)。ガラス薄膜の内面は0.1 mol/l塩酸で一定電位に保たれていますから,変化するのは試料溶液に接するガラス薄膜の外面の電位だけです。電池式で試料溶液の測定の方法を示すと,
銀―塩化銀|0.1M塩酸|ガラス膜|試料溶液∥参照電極
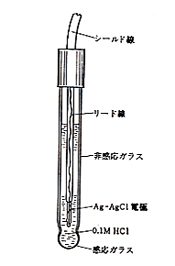
図7.pHガラス電極
この電池式は少々困った形で,現代的ルールから外れています。電池式の書き方の決まりが無かった頃に作られたもので,そのままになっていますが,規則どおり左の電極をアース側に,右の電極を測定端子に繋ぐと,ガラス膜が高い電気抵抗を持っているため試料溶液のビーカーを高絶縁しなければなりません。実際には不可能なので,右の電極をアース側に繋ぎ,左の電極を測定端子に繋いで電位差を計っています。こうすると酸性が強いほどガラス膜の電位が上がり,電位差計は+の方向に動きますが,電池式では逆に-の方向に動かなければなりません。そこでpH計では本体のスイッチ切り換えで電位差計の動きを左右反対にして,あたかも電池式のとおり酸性側が-のようにpH目盛りを打っています。(図8)
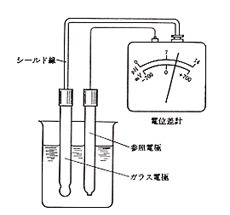
図8.ガラス電極pH計
セーレンセンは最初水素イオン濃度の表示法としてpHを定義しましたが,間もなくこれを修正し,水素イオン濃度の代わりに水素イオン活量aH+を用いることにしました5)。それは同じ水素イオン濃度の溶液でも他の電解質や有機物が存在すると電位差計の目盛り位置が変わるからです.そこで修正式は,
pH=-log aH+
となります。希薄で単純な酸,塩基の溶液では活量と濃度は近い値ですが,いろいろ他の物質が溶けていると相当活量のほうが小さい値になります。生体液などは電解質やタンパクが多く含まれていますから,ここで得られたpHは水素イオン濃度をあまり正確に表していません。
活量が濃度より小さくなるのは,測定イオンが他の電解質などで安定化して,本来の電気化学反応の活力を低下させるからです.掴みどころのない活量ですが,何か標準がなくては困るので,pH標準液というものを作ってこれでpH計の目盛りを合わせます。これは決められた処方の溶液で,わが国ではJIS6)と薬局方7)が制定しています。この内よく使われるのはフタル酸塩標準液(25℃でpH 4.01),リン酸塩標準液(pH 6.86),ホウ酸塩標準液(pH 9.18)で,それぞれ酸性域,中性域,塩基性域の目盛り合わせに用いられます。pH計を使う前には必ずこれら標準液で調整しなければなりません。
ガラス電極は図9のようにpH 2~11の範囲で正しい応答が得られますが,pH 1以下の強酸性では実際より大きな応答が(酸誤差),またpH 11以上では小さな応答が得られます(アルカリ誤差)。アルカリ誤差を少なくする研究がされて,現在はソーダガラスよりリチウム-バリウムガラスを使うものが多くなっています。ガラス電極の表面は水に接してケイ酸ゲルの状態にあるので,乾燥しては機能が失われます。使わないときも絶えず水に浸漬して置かなければなりません。
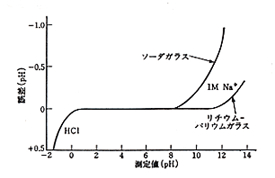
図9.pH電極の酸およびアルカリ誤差
5-1.イオン選択性電極
ガラス電極は米国のコーニング社が開発の中心となりましたが,アルカリ誤差を減少させる目的でソーダガラスにいろいろな元素を添加しました。リチウム-バリウムは成功の一つですが,殆どのものは効果がないか,むしろアルカリ誤差を増加させました。たまたま酸化アルミニウムを加えたところ,奇妙なことにpH2以上で水素イオンに応答せず,溶液中のナトリウムイオンに応答してしまうことが分かりました。(図10)
この現象はロシアのニコルスキーによってつぎのように説明されました8)。
E = const + 0.059 log(aH+ + K potaNa+)
すなわち電極は水素イオンにもナトリウムイオンにも同時に応答するが,応答の強さが違っていて,Kpotが小さいと普通の水素イオン応答になるが,大きいとナトリウムイオン応答になるとされました。Kpotはイオンの選択係数と呼ばれます。コーニング社は (Na2O)11(Al2O3)18(SiO2)71の組成のガラスが最もナトリウムイオンに良く応答することを知り,各成分の頭文字を取ってNAS11-18ガラスと名付けました8).11-18は酸化ナトリウム,酸化アルミニウムのモル組成を表しています。
上の式ではナトリウムイオンを水素イオンに対する妨害と捕らえていますが,もしナトリウムイオンの測定が主というときは水素イオンは逆に妨害イオンになります。このときは書き方を変えて,
E = const + 0.059 log(aNa+ + KNa-HpotaH+ )
少々複雑ですが,KNa-Hpotはナトリウムイオンに対する水素イオンの応答の強さです。NAS11-18ガラスではこの値は10とされています。水素イオンに10倍応答しますが,pH2以上にすればもう水素イオンが殆どありませんから,この状態では括弧内第2項が消えて,ナトリウムイオン応答電極になります。実際この電極は工業用水,河川水,生体液,臨床検査などの測定によく使われています。
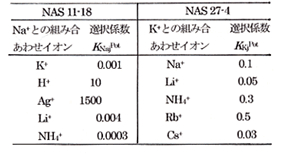
少し組成の違うガラスも作られ,NAS27-4として市販されましたが,こちらはアンモニウムイオンによく応答します.表1にこれら電極の選択係数を示しました。電極材料がガラスですから,金属電極のように酸化-還元系の応答もなく,化学薬品にも耐久性があって,使い易い電極です。何れにしてもイオン選択性電極の先鞭をつけたもので,歴史的にも貴重な存在です。
表1.陽イオン選択性ガラス電極の選択特性
ガラス電極のイオン選択性がどういう理由で起こるかはアイゼンマン(G. Eisenman)の著書 “Glass Electrodes for Hydrogen and Other Cations”8) にかなり詳しく論じられています。少々難解な部分もありますが,その要点は私の解説に紹介してありますので興味のある方はご覧ください9)。イオン選択性電極の測定はpH電極と違って次の電池式によります。
参照電極∥試料液|イオン選択性電極
参照電極を基準にイオン選択性電極の電位を測るので,試料液中の陽イオン濃度(活量)が大きくなれば電位差計は+の方向に動きます。
6-1.固体膜電極
参照電極は内部液の0.1 mol/l 塩化カリウムに対する塩化銀の電位+0.222 ボルトを発現していますが,もし塩化カリウムの濃度が変われば電位も変わります。参照電極では電位の安定が第一ですから,表面積の広い電解銀を使っていますが,安定には時間がかかります。そこで塩化銀の粉末を高温にして圧縮成型したものを電極素材とする,塩素イオン選択性電極が作られました。図11にその断面を示しますが,塩化銀だけでは電気伝導性が小さいので,硫化銀を少量混合しています.同じ方法で臭化銀,ヨウ化銀を素材とする臭素イオン選択性電極,ヨウ素イオン選択性が作られています。
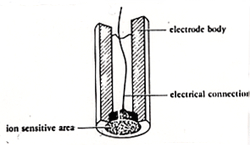
図11.塩素イオン選択性電極の構造
1966年アメリカのフラント(M. Frant)とロス(J. Ross)は画期的なイオン選択性電極を開発しました10)。フッ化ランタンを溶融し,これに種結晶をいれてゆっくり引き上げるとフッ化ランタンの単結晶が得られます。これを薄く切って電極としたフッ素イオン選択性電極が出来ました。フッ化ランタンも電気伝導性が悪いので,溶融塩にユーロピウムを微量添加して実用化されました。フッ素イオン選択性電極の応答特性を図12に示しますが,フッ素濃度で10-5 mol/l(pF 5)まで正確にネルンスト応答します。この電極は水酸イオンに少し応答しますが,緩衝液を使って中性を保てばその影響は殆どありません。市販の緩衝液にはTISAB ( Total Ionic Strength Adjustment Buffer: 酢酸,塩化ナトリウム,クエン酸ナトリウムに水酸化ナトリウムを加えてpH 5.5にしたもの) が有名ですが,割合量が必要なので,自作して蓄えるのが得策です11)。フッ素イオンの測定は水道水,井戸水など健康管理上重要なもので,半導体工業やフッ素樹脂工業の排水などにも監視が義務づけられています。測定にはアリザリン色素による呈色反応のあと,吸光光度法によるものもありますが,フッ素電極法のほうが簡潔です。
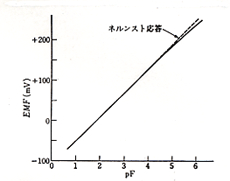
図12.フッ素イオン選択性電極の応答
7-1.液膜電極
ガラス電極はソーダガラスの表面にできたケイ酸の陰イオン性サイトSiO–に,水中の水素イオンが結合してガラス膜の電位を変化させるものでした。今陰イオン性サイトを持った有機化合物を油に溶かし,陽イオンの水溶液に接触させると,界面で陽イオンは水相から油相に移動し,油相の電位を高めます。例えばジデシルリン酸を電気伝導性のあるジオクチルフォスフォン酸に溶かした油は,カルシウムイオンを選択的に取り込みます12)。この油をイオン交換液と称していますが,実際には図13のようにカートリッジ内にイオン交換液をいれ,下部の多孔質膜に浸透させて試料液と接触させます。多孔質膜には孔径100 μmのメンブランフィルターが用いられます。この組み立てには少々技術が必要ですが,現在はメーカーが完成品を提供していますので,それを利用するのが安全です。
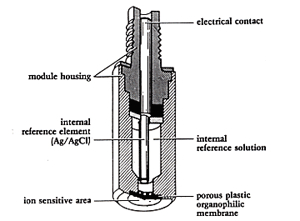
図13.カルシウム選択性電極のカートリッジ構造
カルシウムイオンの測定は,水道水,井戸水,河川水の硬度に関連して大切ですが,マグネシウムと共存することが多く,従来より分離定量の困難なものに挙げられていました。カルシウムイオン選択性電極ではマグネシウムの選択係数が0. 01と小さいので殆ど妨害無く定量が出来ます。ただし水素イオンによく応答するので,かなり試料液を塩基性にしなければなりません。
放線菌の一種であるStreptomyces fulvissimusから抽出したバリノマイシンValinomycin (図14)は抗生物質で,大環状ペプチドのC=O基の陰性に引かれて環の中央にカリウムイオンが取り込まれます。相手の細菌中のカリウムイオンを失活させて死滅させる機能を持っています。環の大きさは進化の過程でカリウムイオンに正確に適合し,他のイオンを殆ど受け付けません。この物質をジフェニルエーテルに溶解して液膜電極を形成させると,すぐれたカリウムイオン選択性電極になります13)。ナトリウムに対する選択係数は0.0002と極めて小さく,病院での血液モニターに威力を発揮しています。バリノマイシンは変質しやすい有機化合物ですから,長期の使用には耐えませんが,カートリッジをメーカーが供給していますので,動作が不良と思われたら取り替えて試して下さい。
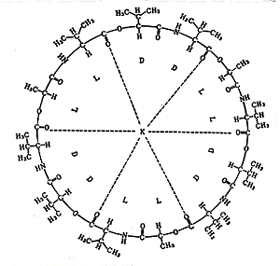
図14.バリノマイシンのカリウム錯体の構造
8-1.直接電位差法
イオンセンサーの信号は感応イオンの濃度(正確には活量)を表していますが,濃度が1けた変わる毎に1価イオンなら59 mV,2価イオンなら29.5 mVづつ変化します。方眼紙に検量線を描くときは横軸に濃度の指数目盛りを,縦軸に電位目盛りを打ってプロットしますが,指数目盛りが1違う隣合わせの間で,例えば含有率50%から5%までがこの間で定量されます。0.3%の許容誤差を維持するには測定精度±0.1 mVの電位差計が必要な理由ですが,市販で最高精度のデジタルイオンメータがこの要求を満たします。
イオンメータの電位は濃度の対数を表していますので,本来は対数→真数の変換をしなければなりません。しかし現代のイオンメータではこの対数変換を内部の電子回路で行っているので,まず濃度表示に切り換え,濃度の異なる標準液を2種作って,それぞれの目盛りを合わせればその間を濃度で読み取ることができます。
検量線の作成にはイオンセンサーが感応せず,かつやや濃い電解質溶液に目的イオンを溶かします。それはイオン強度を一定に保って活量係数を安定させるためです。フッ素イオン選択性電極のときに前述のTISABを用いるのもその理由です11)。ナトリウムイオン選択性電極やカリウムイオン選択性電極のとき,中性緩衝液を用いますが,水素イオンや水酸イオンの妨害を避ける目的以外,緩衝液にイオン強度の一定化を受け持たせています。
電位差計の僅かな測定誤差が濃度の誤差に大きく響きますが,電極電位が外部から妨害を受けないように注意する必要があります。静電気が問題になるときがありますが,空気の乾燥した分析室でポリエステルなど合成繊維の実験衣を着ているとき起こり易いようです。この点では綿製のほうが安全です。電位差計の信号はセンサーと参照電極の電位差ですから,その安定性には参照電極も加わっています。参照電極にはセラミック多孔板がよく使われていますが,ピンホールや摺り合わせキャップ,中にはゴムプラグなどもあります。よく起こる事故はピンホールで,乾燥したまま放置すると内部液の塩化カリウムなどが結晶となって詰まり,電位差が不安定になります。水に長時間漬けて直る時もありますが,復活しないことも多いようです。摺り合わせキャップやゴムプラグは使用に先立って毎回緩めて内部液を流し,電気伝導性を確保しますが,内部液の流失も多いので補充を怠ってはなりません。その代わり電位差の安定性は極めて良好です。
8-2.電位差滴定
滴定は指示薬を用いる目視法が古くからあって,当量点で変色したり,着色や脱色をするまでの標準液量をビュレットで測定しました。色の判別は個人差があって当量点の認識が違うこともあり,また色の変化の乏しいときは当量点を見失うこともよくありました。もし目的物質か加える標準液のどちらかにイオンセンサーが応答すれば,当量点でセンサーの信号が急に現れるかまたは消滅しますから,滴定曲線を描けば標準液の量が分かります。指示薬を探す苦労もなく,自動滴定装置を使えば滴定曲線も当量点もデータ処理をして打ち出してくれます.
電位差測定が濃度の対数と比例するので,これから濃度を読み出すにはよほど精密な電位差計を使う必要がありましたが,滴定法では当量点で濃度が殆どゼロになり,対数的には無限大に近づくため電位差が突然大きく飛躍します。電位差計はこの飛躍点を捉えればよいので,計器としては必ずしも最高精度のものを要求しません。
酸-塩基滴定は pH計が出来た頃からよく使われました。図15は0.01 mol/lの塩酸100 mlを0.1 mol/lの水酸化ナトリウムで滴定したときの様子を示しています。10 mlの水酸化ナトリウム液で当量になりますが(領域A),水素イオン濃度が直線的に減少してもpHはあまり変化せず,最後に殆ど垂直に上昇します。理論的には電位差無限大になるのですが,水の解離があるのでpH 7に止まります.滴定をさらに続けると今度は水酸イオンが増加してきて,それまでとは正反対の曲線を描きます(領域B)
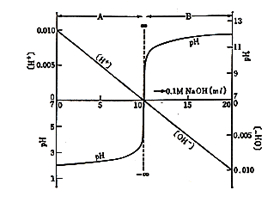
図15.酸ー塩基滴定曲線と[H+]および[OHー]の変化
これをシグモイド曲線sigmoid curveと言っていますが,当量点の探し方で微妙な違いがあります。マニュアル滴定で標準液の注加量と電位差を方眼紙にプロットしたときは図16のように45°の接線を二本引き,その中間線と曲線の交点を求めます。しかし自動滴定装置では単位の滴下量に対し電位差の変化が最大のところを表示します。一種の微分滴定ですが,データ処理が簡単なのでよく使われています。別の方法として濃度既知の溶液に当量の標準液を加え,その時の電位差を記録しておき,滴定曲線がその電位差に達したときの点とすることもあります。こうなると3種のうちどれが本当の当量点か議論が分かれますので,われわれは当量点と言わず,採用した方法での滴定終点と言っています。こうして終点の求め方が決まれば,既知量の目的物質を標準液で滴定して,標準液1 ml当たりの目的物質量(ファクター)を計算し,以後の定量にこれを使います。
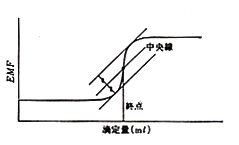
図16.滴定終点の求め方
標準液の注加には以前ガラス製ビュレットが使われ,滴定の字のとおり上から滴を落としましたが,現在は学生実習以外には使われず,毛管チップの先端を試料液に漬けてピストンビュレットで注加します。ビーカーの試料液を磁気かきまぜ機でよく混合しながら標準液を加えますが,マニュアル操作では電位差計の動きが大きくなると注加速度を遅らせ,なるべく平衡を保ちながら細かく注加量と電位差を記録し,飛躍点を通過させます。あとで方眼紙にプロットして終点を作図で決めます。自動電位差滴定装置ではこの作業を全部電子回路が行いますので,少々設備に経費は嵩みますが,それだけの価値はあります。
塩素イオンの銀滴定には塩素イオン選択性電極が良い結果をもたらしますが,臭素イオンやヨウ素イオンが共存すると電極表面が臭化銀,ヨウ化銀に変わり,塩素イオンに応答し難くなります。この場合電極表面をよく洗った鹿皮で軽くこすると表面が更新されて,元の塩素イオン応答が復活します。微量領域の塩素定量のみでなく,1 mg以下の超微量定量に用いて精度の良い結果が得られます14)。
8-3.自動電位差滴定装置のアクセサリー
電子回路で制御された滴定装置ですから,電位差滴定以外にいろいろな機能を備えています。そのうち微量分析に活用できる技術としては,双白金分極滴定と吸光光度滴定があります。前者は二本の白金電極を備えたガラス筒を用い,本体から微小な電流を流して陽極と陰極に分極させ,当量点で急に電流が流れなくなる点を検出します。また後者はプラスチック製の円筒に発光ダイオードを内蔵し,その光を溶液に通して反射させ,反射光の強度から吸光量を測定します。一種の指示薬滴定ですが,目視法よりはるかに鋭敏な色の変化が掴めます。
双白金分極滴定では電極間に2~200 mVの直流電圧をかけ,流れる微小電流を測るので電位差滴定ではありませんが,酸化-還元系の滴定によく用いられます。水分の微量定量にカールフィッシャー法Karl Fischer titration というのがありますが15),3-p308),ここでは微量の水を含む試料を脱水したメタノールに溶かし,ヨウ素と二酸化硫黄を溶解したピリジンで滴定すると,水はヨウ素と二酸化硫黄を反応させ消費されて行きます。当量点までは加えたヨウ素が還元されて全部ヨウ素イオンになっているので分極電流は流れませんが,当量点を過ぎると突然ヨウ素が現れ,酸化-還元系が成立しますから両極間に電流が流れます。鋭い屈曲点を与えるので,これを滴定終点とします。カールフィッシャー法は結晶水,吸着水,その他食品,工業品,中には絶縁油の品質などのモニターに使われ,大切な分析部門ですが,詳しいことは専門書を参考にして下さい。
光度滴定は目視滴定のセンサーを目から光度計に置き換えたもので,かなり古い技術ですが,分光器が本体の装置です。しかし電位差滴定装置を本体とする光度法というのが最近可能となり,小さな発光ダイオードを電極の形をしたプラスチックの円筒に納め,ここから放射する単色光を溶液に通して光の吸収を測定します。電極と同じように操作できるのですこぶる便利です。(図17) 試料液は円筒の下端の内部を流動していますが,光路長は20 mmと一定なので反射光の光量を半導体センサーで検出します。波長は550 nmと660 nmが選べますが,硫酸イオンのバリウム滴定にスルホナゾIIIを指示薬としたときは660 nmが適当です。当量点付近で急峻な光度変化が起こり,1 mg以下の有機硫黄試料の分析に精度の高い分析結果が得られました16)。
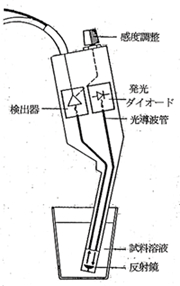
図17.光度滴定用センサー
9-1.おわりに
電気分析はイオン性物質が電荷のやり取りをする現象に基づいた技術ですから,化学反応を電気的に検出し,そのあと増幅,測定,記録が容易です。分析化学の中でも歴史の古い部門で,広大な理論,方法論,応用域が展開しています。この小論で全体像を伝えることは出来ませんが,微量分析に直接利用できる技術を抜き出して解説を試みました。
電気分析では電極間の電流を測る方法と電位差を測る方法とがありますが,前者は一種の電気分解で,イオン種が化学変化をしてしまいますから,微量分析にはあまり好適と言えません。電位差測定では原理的に化学変化はないので,溶液内の平衡状態がそのまま検出できます。電位差と目的イオンの濃度がネルンスト式で表され,濃度の対数に比例するのは難点で,電位差を少し測り間違うと濃度の値に大きく響きます。直接電位差法で濃度を測定するには,最高精度の電位差計を静電気など妨害を排除して使うことが必要です。
電位差滴定は電極を当量点の検出に利用するので,対数の持つ不思議な性質を活用しています。ゼロの対数が無限大ですから,目的イオンが無くなるか,現れるとき突然指針が振れるので,当量点はこの辺りだと教えてくれます。pH電極をはじめ各種のイオン選択性電極が市販され,電位差計または電位差滴定装置があればさまざまな分析試料に対応できる便利な時代になっています。
10-1.参考文献
1) 仁田 勇編: 現代物理化学講座,1, 化学入門,p47,東京化学同人(1966).
2) 日本化学会編: 実験化学講座1,基礎技術,p320,丸善 (1957).
3) 穂積啓一郎,北村桂介: 機器分析通論,広川書店(1980).
4) 益子 安: 分析ライブラリー 11,pHの理論と測定,p 11,東京化学同人 (1967).
5) S. Sφrensen: Biochem. Z. 21, 131, 201, (1909).
6) 日本工業規格: JIS K0018,K0020,K0021.
7) 日本薬局方解説書編集委員会編: 第14改正日本薬局方解説書,B-502,広川書店.
8) G. Eisenman:“Glass Electrodes for Hydrogen and Other Cations” Mercel Decker,New York (1967).
9) 穂積啓一郎: 化学の領域,26,881 (1972).
10) M. Frant,J. Ross: Science,156,1378 (1967).
11) 穂積啓一郎,秋元直茂: 分析化学,20,467 (1971).
12) J. Ross: Science,156,1378 (1967).
13) R. Durst (ed.):”Ion-Selective Electrode”,National Bureau of Standard, Washington. D.C. (1969).
14) 穂積啓一郎,北村桂介,田中喜秀: 分析化学,38,259 (1989).
15) K. Fischer: Angew. Chem., 48, 394 (1935).
16) 穂積啓一郎,佐藤綾子,秋元直茂: 分析化学,47,219 (1998).

