

TOPICS
CHNフォーラム
第二部 フラスコ燃焼法と密閉反応器
- 1-1.はじめに
- 2-1.カリウスのガラス封管法
- 3-1.パールボンブ法
- 4-1.ろ紙を用いる燃焼
- 4-2.シェニガー博士のプロフィール
- 4-3.定量の方式
- 5-1.ホットフラスコ法
- 6-1.水銀ビュレットによる検圧測定
- 6-2.封管内測容法
- 6-3.ヘテロ元素の定量
- 7-1.おわりに
- 8-1.参考文献
- 関連装置
1-1.はじめに
有機化合物の化学構造の認識には非破壊分析法によるものと,破壊分析法によるものとがあります。赤外スペクトルや核磁気スペクトルは前者の代表で,元素分析や湿式の原子団分析は後者に属します。ガスクロマトグラフィーや質量分析は部分的な破壊があるのでどちらとも言えませんが,このような分類の議論はさておき,元素分析は端的に完全破壊と定量的な回収の技術で特徴づけられています。
有機物が地球に出現したのは45億年前の火の玉が冷えた頃からで,水蒸気が凝縮して水となり,海ができて植物プランクトンやアメーバが二酸化炭素や太陽エネルギーを吸収して大量の有機物を作り出しました.植物や動物が陸に上がり地表を覆うようになったのはずっと後のことですが,遺伝子の指令に基づいてそれぞれの生物が独自の生化学合成を行って,無数の有機化合物を作り現在にいたっています.近代になって有機化合物を人間が合成することを覚え,合成繊維,プラスチック,医薬品,農薬など膨大な数の人工物質が生産されています。
化合物の構成要素を知るための元素分析は,1800年代の始め有機化学という科学の生まれた頃から必要不可欠の化学技術として進歩してきました。有機化合物の分子が炭素や水素など限られた種類の原子から出来ていることは,化学者を大いに勇気づけました。二三の元素の分析法がすぐに膨大な数の有機化合物の分析に応用できるからです。リービッヒ (J.Liebig) が炭素,水素の分析法を開発したことは歴史に残る貢献ですが,100 年後のプレーグル (F.Pregl) の微量分析のほうが華やかな脚光を浴び,ノーベル賞を受けることになりました。もっともリービッヒの頃はまだノーベル賞が無かったので仕方がありません。
リービッヒもそうですが,プレーグルも有機物を完全燃焼させることに随分苦労しています。コークス炉からガス炉への進歩はありましたが,現在の電気炉に比べると十分な温度が得られたとは思えません。これを補うための酸化充填剤の工夫などにその跡が見られます。燃焼管と吸収管をつなぎ,キャリヤーガスで燃焼生成物を送るという方法が効率のよい分析法として現在も主流になっていますが,流れる燃焼ガスの完全酸化や完全吸収を果たすには少々きわどい条件を充たさなければなりません。それは燃焼管充填物や吸収剤との接触時間が限られているからで,長い経験から微量分析ではこれくらいでよいという分析条件が生み出されました。
定量分析では目的成分を100%捕らえて結果を出さなければなりません。このため分析プロセスのどの段階でも中途半端や行き過ぎがあっては分析誤差として現れてきます。化学反応は速いものや遅いものがあって,複合系の反応では一番遅いものを律速反応といっていますが,これが完了するまで待つことが必要です。化学反応は分子や原子が互いに衝突して新しい物質を作る現象ですが,最初は原料が多いのでどんどん反応が進むものの,だんだん原料が減ってきて反応が鈍くなり,最後はほとんど反応が進行しなくなります。理論的にいえば反応完結には無限時間かかることになります。そこでわれわれは反応の進行が分からなくなった時点を反応完結としています。
CHN分析などキャリヤーガスを用いる流通系反応装置では分析能率を上げるために,分析結果が許容誤差範囲に入っておれば反応も完結したものとしていますが,案外最後の部分は切り捨てているのかも知れません。ときどきベースシグナルが大きくなって前の分析の影響かと思ったりしますが,反応のやり残しも原因に含まれるでしょう。
手作りのパンやおふくろの味の学生食堂がときどき見られますが,要するに大量生産のものと違って一品一品時間をかけて丁寧に作られていることを言っています。作る人と食べる人が料理法と味の評価を直接交換できますから,その場所では一番よいものになります。機器的な方法がまだ無かった時代はまさに手作りの分析法で,時間がかかろうと,手間が面倒であろうと,正確な分析結果が得られることを至上の目標として取り組みました。化学反応も必要以上に時間をかけ,場合によっては一夜放置して次のステップに進むこともありました。長時間の反応中目的成分を絶対逃がさないための密閉反応器もいろいろ工夫されています。硫黄やハロゲンの分析に利用される酸素フラスコ燃焼法もその過程で生み出されたものです。現在は速戦即決のキャリヤーガス方式が全盛で,密閉反応器に対しては関心が薄くなっていますが,定量分析の本来の目的には後者のほうが向いています。何もかも自動機器化を進めてきた現代の反省をこめて,密閉反応器のよさについて書き留めておきたいと思います。
2-1.カリウスのガラス封管法
化学反応は温度が高いほど速くなり,破壊的になります。物質の温度とはそれを構成する分子や原子の運動エネルギーのことで,気体ではランダムに走る粒子のエネルギーですが,液体や固体では密集粒子が隣どうしでぶつかり合う力になっています。この運動エネルギーは絶対温度零度(-273℃)で消滅しますが,逆にいうと常温でも絶対温度300度ほどはあるわけで,われわれはこの熱エネルギーで食物を消化したり,走り回ったりしています。
食物に熱を加えて調理すると細胞膜が壊れて柔らかになり,蛋白が分解してアミノ酸になるなど,常温で得られなかった好ましい味覚が生まれますが,度が過ぎると黒焦げになってベンゾピレンなど発ガン物質を作ります。物を水で煮ると言うことは,水の沸点が100℃なのでいつもこの条件で処理できる利点がありますが,もう少し加熱を強めて香ばしい食品にしたいときは,沸点の高い油で揚げるという手があります。圧力釜を使うと骨まで崩れますが,ここでは釜の中に水蒸気が閉じ込められ,膨張できないため圧力が上がって水の沸点も上昇しています。
化学の世界でも少々の加熱では起こりにくい反応を,密閉器中で温度を上げることで実現することがよくあります。オートクレーブという高圧化学反応装置が古くから使われていますが,この原理を利用したカリウス (L.Carius) の封管分解法1,2) は有機試料中のハロゲンや硫黄の分析に随分長く用いられました。ガラス管から安価に自製できるところが特長です。最初はマクロ分析ですから数百ミリグラムの試料を外径14 mmほどの太い硬質ガラス管に入れ,発煙硝酸と硝酸銀または塩化バリウムを加えて封じ,炉で300℃ほどに加熱しましたので,内圧も相当なものになります。ガラスのどこかにひずみでもあると爆発し,発煙硝酸が飛び散って散々な目に遭うことがときどきあったようです。しかしこの方法によってハロゲン,硫黄のほか,りん,ヒ素,セレンなどヘテロ元素の定量ができるようになって有機化学の研究推進に大きな貢献を果たしました.
微量はかりの出現によってプレーグルは一連の微量分析法を作り上げましたが,カリウスの封管法もそのレパートリに入っています 3~5).ここでは外径11 mmほどの封管を用い,数ミリグラムの試料に発煙硝酸0.5 mlと沈殿試薬を加え分解します(図1). 分解時間は3時間ほどで終りますが,ポリマーや高ハロゲン化合物では任意に延長することになっています.このあたりは密閉反応器のよいところで,封管の厚い壁で守られて何時間かかっても成分が逃げたり,また外から妨害物質が侵入するようなことがありません.
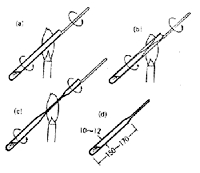
図1.ガラス封管の作り方
発煙硝酸の強い酸化力で有機質は二酸化炭素と水になりますから,あとあと定量の妨害にならないのもよい点です。硫黄は硫酸バリウムに,ハロゲンはハロゲン化銀になって沈殿しますから,封管の先を切って水小量を加え,ろ過すれば沈殿の量が測定できます。ろ過にはG4のガラスフィルターを用いますが,フィルターごと微量はかりに載せて計量するので,口径の小さい軽量のものになり,封管から直接沈殿を移すことは困難です.このためサイフォンを用いて吸引ろ過をすることが行われます(図2)。 この方法のもう一つの利点は化学増幅です。S = 32.06がBaSO4 = 233.43と約7.3倍になり,Cl = 35.45もAgCl = 143.35と約4倍に拡大されます。このためフィルターの 計量誤差も分析値への影響がかなり小さくなります。クールマン微量はかりは今日の進歩した微量はかりと精度の点で太刀打ちできませんが,この化学増幅のおかげで結構よい分析結果を出していました。
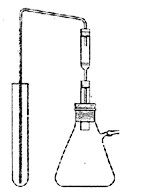
図2.微量沈殿のろ過
正直言ってカリウス法で硫黄やハロゲンの分析をやろうとする人はもういないでしょう.分析結果がよいから支持されるという時代ではなくなっています.封管を作るガラス細工の面倒さ,炉で加熱したときの爆発の危険,沈殿のフィルターへの移し変えとその乾燥,計量など,便利さに慣れた現代人には不向きなことばかりです.しかしあえて書き留めておきたいのは,定量分析の究極の精度を求めて先人が工夫を重ねた歴史と努力です.便利さの陰には往々にして面倒なところを省略する傾向があります.世の中が皆そうであれば自分もこれでよいと納得してしまいますが,僅かな手間をかけるだけで随分改善できることもあり,先人の知恵と経験を思い出して生かせるチャンスがいくらでもあります.
3-1.パールボンブ法
ボンブとは爆弾のことで,金属容器を反応 器として700℃に加熱することから勇ましい名前がついています.この分解法は1908年パール (S.Parr) の考案によるもので 6),パールボンブ法ともいわれますが,後に微量化されました(図3).
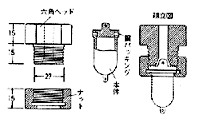
図3.パールボンブの断面
最初はニッケル製の容器が用いられましたが,現在はステンレス鋼製になっています。硫黄やハロゲンを含む試料を過酸化ナトリウムと溶融するので,激しい反応が起こり,数分で分解は終了します。分解後反応物を洗い出し,沈殿法,滴定法,比色法などで定量できます。フッ素系ポリマーなどカリウス法で分解困難なものまで適用可能で,優れた方法の一つと考えられますが,やはり容器の洗浄,力の要るボンブの組み立てと分解,マイクロバーナーによるボンブの加熱など,忙しい微量分析者の間ではあまり人気がありません。
パールボンブ法ほど激しい反応ではありませんが,テフロンで内部を覆って試料と分解液を入れ,加熱するユニシールの装置があります 7)(図4).もともと原子吸光やICP分析の前処理用に考えられたもので,パールボンブのように金属が分解液と接触しないので金属の定量に向いています。テフロンは高分子材料のうちかなり高い温度に耐えますので,濃硝酸,過塩素酸などとともに140℃で有機質を分解し,金属イオンとすることが出来ます。内容積は25~100 mlの範囲でいろいろありますが,特に微量用としては9 mlの全テフロン製もあります。加熱には定温乾燥機を用い十数本を処理できます。
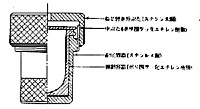
図4.ユニシールの構造
さらに新しい方法としてマイクロウエーブを用いる湿式分解法が登場してきました 8)。これも原子吸光などに使われるもので,有機元素分析への応用例はほとんど報告されていませんが,全テフロン製の加圧容器に試料と分解液を入れ,蓋をして十数本を円形に並べ,回転しながらマイクロウエーブを照射します。電子レンジと同じ原理で分解液が加熱され,有機質は酸化分解し,金属元素はイオンとなって溶解します。温度は自動制御されますので,安全に分解がおこなわれます。かなり高価な装置ですが,成分の汚染や損失がない点は評価できます。
4-1.ろ紙を用いる燃焼
この有名な燃焼法はヴォルフガング・シェニガー(Wolfgang Schoeniger)によって1955年考案され 9),たちまち世界中に広がりました。 実際このフラスコを使った人は簡単な仕組みとその効用の高さに驚くとともに,どうして自分がもっと早く気がつかなかったのか残念に思ったでしょう。 コロンブスの卵とはこういったものを指すに違いありません。
酸素フラスコ法が微量分析者の間で突然浮上してきたので,原理そのものも新しいように思われましたが,実は1892年すでにヘンペル(W.Hempel)がその原型らしいものを発表しています 10)(図5)。どうも最初は石炭の品質試験のための硫黄の含量測定にあったようで,10リットル容量の大きなガラス瓶の中で試料に電気着火させています。 当時はマクロ分析ですから,粉末にした数グラムの石炭試料は酸素雰囲気中で自燃し,あと臭素水をガラス瓶に注入して二酸化硫黄を硫酸イオンに変換しています。 定量形は硫酸バリウムの沈殿による重量法です。 その後5リットルの瓶を用いて試料量を200~500 mgに下げた報告もありますが 11),これ以下の試料量ではもう自燃しないと思われたか,すっかり忘れられていました.。数ミリグラムの試料では当然発熱量が不足で自燃しませんから,微量分析の時代になるとハロゲンや硫黄の定量に専らカリウスの封管法かプレーグルの燃焼管法が用いられました。第二次大戦後は沈殿法や滴定法などウエット方式よりドライ方式が好まれるようになり,燃焼管法でハロゲンや硫黄を加熱銀に捕らえ,銀の増量を測るいろいろな工夫が発表されました 12), 13)。 加熱銀法は特にわが国で大きな進歩をとげました 5)。 こうして時代は確かにドライ方式の方向に進んでいたのですが,そこへ突然酸素フラスコ法が復活し,あまりに手軽で便利なため,ウエット方式に逆戻りするにも拘わらず,ほとんどの微量分析室が加熱銀法を捨てて酸素フラスコ法に乗り換えてしまいました。
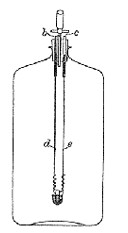
図5.ヘンベルの燃焼瓶
シェニガーの酸素フラスコでは微量の試料をろ紙で包み,ろ紙の燃焼熱を利用して分解するところが成功の秘訣であったわけですが,500 mlほどの三角フラスコにすり合わせガラス栓をはめて密閉容器とし,外界と遮断できるところも微量分析に向いています(図6 )。ガラス器具ですから僅かな費用で一式が揃えられるのも魅力でした。 間もなく欧米薬局方の試験法に収載され,わが国のJISや日本薬局方も採用したものですから,民間の研究所や試験室にも多く見られるようになりました。
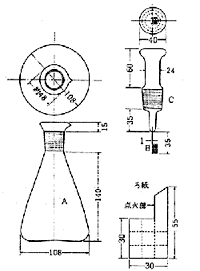
図6.シュニガーの酸素フラスコ
この鮮やかな成功を収めたシェニガーはしかし残念ながら気の毒な終末を迎えました。 1971年2月23日深夜自宅の地下ガレージで車のエンジン調整中,一酸化炭素中毒で倒れ,翌日早朝夫人に発見されましたが,そのまま不帰の人となりました. 50才の円熟期のことでした。
筆者は1965年スイス・バーゼルにあるサンド社 (Sandoz A.G.) の微量分析室に同博士をお訪ねし,詳しく設備を見せていただきましたが,明るくて整理の行き届いた実験室の窓際にいろいろな観葉植物が飾ってあって人柄がしのばれました。その後1972年の4月には京都で国際分析化学会が開かれることになり,同博士も来日を予定されていました。 初めての日本訪問であり,楽しい旅行の期待をたびたび書き送ってこられました。学会の一年前の3月夫人から突然訃報を受け取ったときは全く信じられない気持ちでした。
シェニガー博士の人物像を書留めておきたいと思い,同博士と親交のあったホフマン・ラロシュ社のディルシャール(A.Dierscherl)博士に紹介文をお願いしました。その内容は南江堂出版の「化学の領域」に記載してもらいましたが14),大分昔のことなので現代の皆様はご存知ないかと思います。 重なるようですがもう一度概略を述べておきたいと思います。
4-2.シェニガー博士のプロフィール
シェニガー博士は1920年チェッコスロバキアのカールスバードで生まれ,ハイスクール卒業後,1939年プラーグ工科大学に入学し化学を専攻しました。 1945年同大学で自然科学博士の学位を受け,ちょうど第二次世界戦争が終わった機会に,オーストリアに移り,グラーツ大学のプレーグル研究所で微量分析の研究を始めました。間もなく同じ大学の医学部を出たアンネマリー・ライヒェル (Annemarie Reichel) と結婚し,オーストリア国籍を得ました。 この頃から原子団分析を中心に微量化学の論文が多数出始めています。
国際的に知名度が上がるとともに,1950年にはオーストリア微量化学会からプレーグル賞が与えられました。1951年にはフルブライト奨学生としてアメリカに渡り,カリフォルニア大学のカーク (P.Kirk)教授から超微量分析の手ほどきを受けるなど,分析技術のレパートリーを広げました。
1953年スイスのバーゼルにあるサンド社の医薬品部門で微量分析室の設置が計画され,同博士が主任として招かれました。 着任して間もなく酸素フラスコ燃焼法を考案し,学会誌に発表したところ世界中の微量化学者の注目を集めました。 酸素を充たした三角フラスコの中で,ろ紙の燃焼熱を利用して有機試料を分解する鮮やかな手法は見事というべきです。 あらかじめ小量の吸収液を入れ,すり合わせ栓で密封されているので,分解ガスはゆっくりと定量的に吸収液に取り込まれます。
アイディアの豊富な人で,微量分析室の運営だけでなく,社内の新しい研究施設の計画や設計には必ず重要スタッフとして参画していました。 国際学会では花形的存在で,英独仏語が自由という多才でユーモアのある人物でした。 こんな話も伝わっています。 アメリカで招待講演があったとき,いたずらな博士の友人が講演スライドの中に一枚のヌード美人の写真を入れておきました。 講演が進んで,突然このスライドが写ると満場沸き返りましたが,同博士はまじめな顔で,“これはどうも失礼しました。 次の講演者のフラシュカ (Flaschka) 教授のスライドが一枚まぎれ込んでおりました。
研究面での活躍もさることながら,人間味豊かな趣味にも恵まれ,家族とともにアルプスの山歩きや写真撮影が特に好きでした。 フラスコの中でヨウ素を含む試料が燃焼したときの一瞬の美しい炎を捉えたカラー写真はオーストリアの科学写真展で入賞しました。またアルミニウムボートの白黒拡大写真は“光と影”のテーマで,これを見た人はその冷厳な美しさに深く感動したといいます。
シェニガー博士はスイスを心から愛し,事実スイスの微量化学を代表する人でした。 しかし積年の望みであったスイス国籍は遂に得ることが出来ずオーストリア国籍のまま生涯を終わりました。 それは国籍取得条件が他の国よりはるかに厳しいことによります。 あるとき友人に洩らした言葉によると,当時15才になる長女は水泳が得意で,“Gaby -(長女の名前,多分Gabriel)- はスイスナショナルチームのメンバーになろうと懸命に練習に励んでいるが,もし実現すればスイス国籍を取るに有利となる”とのことでした。 法制上の問題はさておき,われわれはシェニガー博士をスイスの微量化学者と考え,また同博士もそう扱われることを一番喜ばれると思います。
来日を目前に突然襲った不幸は世界の微量化学者に深い悲しみをもたらしましたが,博士の短い生涯に残された不滅の業績は,酸素フラスコ法とともにいつまでもわれわれの心の中で生き続けることでしょう。
4-3.定量の方式
微量分析用の酸素フラスコの容積は300 mlから500 mlまで,使う人によっていろいろですが,個人的な見解として400 mlあたりが無難なように思います。 フラスコに吸収液を入れ,ろ紙に点火してすばやく栓をはめ,栓を下にして燃焼が終わるのを待ちますが,少々加圧になるので,しっかりと栓を押さえている必要があります。 初心者はこわごわ扱うため,よく力負けして吸収液を噴出させたりしますので,はじめは水を吸収液として練習すべきです。
長年にわたって無数の燃焼が行われましたが,少なくともわが国ではフラスコが爆発した事故は報告されていません。 それでも用心深い方はプラスチックめがねを着用したほうが安心でしょう。 欧米ではフラスコを金網で覆ったり,またろ紙の点火を外部回路から電気的に行ったりするものがありますが,少々心配しすぎで,かえって取り扱いが面倒になるように思います。
吸収液は目的元素や測定原理によって異なりますが,塩素の場合には水でよいというのが通説になっています 15)。 理屈では塩素分子Cl2や次亜塩素酸HClOが生成しているので,これを塩素イオンに還元するため過酸化水素水を加えることが必要と言われていましたが,微量分析のような希薄な水溶液では加水分解によって定量的に塩素イオンになっていることが分かりました。 ただし臭素とヨウ素は硫酸ヒドラジン溶液を加えてそれぞれ臭素イオンとヨウ素イオンに還元しなければなりません。
ハロゲンイオンの定量法には古い歴史がありますが,たまたまフラスコ燃焼法が考案された頃,キレート試薬が次々合成され,このうちジフェニルカルバゾンが水銀とピンク色の錯体を形成することが分かりました。 この試薬を指示薬として硝酸水銀で滴定すると無色からピンク色に敏感に変色し,滴定値の再現性もすばらしいことが報告され 16),たちまち世界中に広がりました。
折角よい方法が見つかったのに,残念ながら水銀公害が出て,厚生省の管轄である日本薬局方は率先して水銀滴定法を廃止してしまいました。 代わりに現在は硝酸銀による電位差滴定になっていますが,自動電位差滴定装置が必要でかなり高価につきます。
フッ素はハロゲン族の元素ですが,塩素や臭素とは性質が大分違っています。 フラスコの吸収液は水でよいのですが,よい滴定法がなく,このためアリザリンコンプレックソンのセリウム錯体がフッ素イオンと複合錯体を形成するときの発色を吸光分析法で測定しています17)。 注意すべき点は,セリウム錯体がすでに赤ぶどう酒色をしていて,光の透過量が乏しく,この状態でフッ素錯体を作っても透過量の変化は僅かです。 この変化を正確に測定しようとすると,かなり感度のよい分光光度計を使用しなければなりません。 学生実習用の簡単な装置ではノイズに負けてしまいます。
フッ素イオン選択性電極を用いることもできます 18)。 イオン濃度の対数と電極電位が直線性を持ちますので,片対数方眼紙の上で検量線を引くのが正式ですが,最近はデジタル表示のイオンメータに対数変換機能が備えられてあって,標準濃度の液で二箇所チェックすれば,あとは未知試料の液の濃度を表示してくれます。 しかしイオン濃度の対数が電極電位で現れる原理は同じなので,1けた濃度が変わっても60ミリボルトしか電位が動きません. このため電位差計は分解能の高いものを使用しなければなりません. 0.1ミリボルトが安定に読めることが必要です。
フッ素はガラスの構成物であるケイ酸と反応して四フッ化ケイ素を形成し,定量値に負の誤差を与えると考えられたことがありましたが,これは間違いと判明しました。 負の誤差の原因はガラス中のホウ酸と反応して四フッ化ホウ素酸を形成するからです 18)。 四フッ化ケイ素は容易に加水分解してケイ酸とフッ化水素になりますが,四フッ化ホウ素酸は安定でフッ素イオンの定量に掛かりません。 硬質ガラスやパイレックスは特にホウ素が多いのでフッ素分析には使用できません。 少々高価につきますが,石英ガラスのフラスコが推奨されます。
硫黄分析では吸収液に過酸化水素を用いることが一般です。 スルフォン酸とスルフィドでは燃焼ガス中の硫黄酸化物の種類や存在量がかなり違うと思いますが,過酸化水素に触れると全部硫酸イオンになります。硫酸イオンは過塩素酸バリウムで滴定すると,当量点でバリウムイオンが過剰となりますから,発色試薬を入れておくと終点が分かります。
この発色試薬は最初トリンを用いるのが一般的でしたが 19),橙色から僅かにピンク色を帯びる変色が見分けにくいため,アルセナゾIIIに次第に切り替わりました 20)。 この発色試薬は赤紫から青に分かりやすい変色をするのですが,滴定終点を過ぎて暫くするとまた元の色に戻る欠点がありました。 そこで一定過剰の過塩素酸バリウムを加えておいて,硫酸標準液で逆滴定すれば色の戻りはなくなることが分かり,定量値の再現性もよくなりました21)。 この方法は日本薬局方の酸素フラスコ燃焼法に採用されています。 逆滴定は分析試料の当量が大体予測されていないと過剰の標準液量が決められませんから,品質管理など似たような試料が多いところでは有効ですが,研究室の試料のように何がくるか分からない所では不便な面があります. そういう場所ではカルボキシアルセナゾを指示薬とする順滴定が選べます 22)。 当量点付近で赤紫から青に変化しますが,慣れれば終点の色を再現性よく認識することができます。
吸収液中のイオン種をイオンクロマトグラフで定性,定量する新しい技術が広がってきました。 イオンクロマトグラフはかなり高価な分析装置なので,酸素フラスコの手軽さと比べると釣り合いが取れませんが,フラスコ燃焼を試料の前処理と考えれば納得できるでしょう。 分離カラムはイオン交換容量が極めて小さく,デリケートな材料ですから,僅かな汚染物で機能が低下することがあり,ガードカラムでしっかり汚染から守らなければなりません。
りん,ヒ素など非金属元素のほかナトリウム,カルシウムなど金属元素の定量にもフラスコ燃焼法が利用できます。 吸収液や定量法には元素に合わせたバラエティがありますが,詳しいことは文献をたどってください 5)。
5-1.ホットフラスコ法
酸素フラスコ法ではろ紙を燃焼させて試料を分解していますが, ろ紙の量が試料より圧倒的に多いので, 空試験値もそれだけ高くなります。 微量分析からさらにスケールダウンしてサブミリグラム領域に入ろうとすると, ろ紙を使わない燃焼法が望まれます。 スエーデンのキルステン (W.Kirsten) は一端を閉じた石英燃焼管を加熱炉の中にいれ, 酸素を吹き込んだ上, 0.5 mg以下の試料を採取したはかり管をすり合わせ栓とともに加熱部に挿入しました23)。すり合わせ栓には吸収液が小量入れてあるので, 数分間放置すれば燃焼ガスは吸収液に吸い込まれます(図7)。
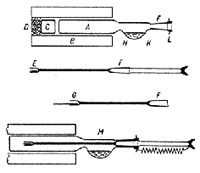
図7.ホットフラスコ燃焼法
酸素フラスコの容積は考えてみればろ紙を燃焼させるための酸素量であったわけで, 試料そのものの必要酸素量は数mlでよいはずです。 ホットフラスコ法はまさに必要かつ十分な条件を充たす無駄のない燃焼手法で, 超微量分析に大きな可能性を含んでいます。 ただし全体が手作業の分析法ですから, このままでは現代人にあまり受けがよくないかも知れません。
6-1.水銀ビュレットによる検圧測定
話が前後しますが, ホットフラスコの考案の数年前にキルステンは完全ドライなCHN分析法を提案しました24)(図8). 個性的な方法で, 何かヒントになる前例があるかと探しましたが, どうも見当たりません。 もともとサブミリグラム分析を目標として, 水, 二酸化炭素, 窒素を真空ビュレットにとり, 低圧で体積を拡大しながら測定しようという構想を立てたようです。 このため0.5 mg前後の試料を採取して, 一端を閉じた細いガラス管にとり, 小量の銅網と過マンガン酸銀を入れて酸素を静かに吹き込み, 空気が入らないようにして他端を閉じました。 閉じるときガラスを少し引き伸ばして, あとで折れやすい形にしておきます。 ガラス管は600~700℃の温度に耐えるものが必要ですが, 石英ガラスは細工がしにくく, 高価につきますので, 代わってエナ・スプリマックスまたはパイレックス#1720が利用されました。
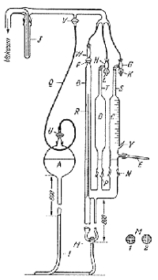
図8.検圧法によるCHN分析
ガラス細工には市ガスに酸素を添加できるコンビネーションバーナーを使います。 こうして出来た燃焼管は数個まとめて燃焼炉に入れ, 650℃に1時間放置します。 試料は酸素によってまず燃焼し, ハロゲンや硫黄は過マンガン酸銀によって固定されます。 窒素酸化物が生じたときは還元銅によって窒素ガスとなり, 最後に残った酸素は時間をかけて全部銅に吸収され, 燃焼管内は水, 二酸化炭素, 窒素のみとなります。
測定には巨大な水銀ビュレットの本体に, 回転できるすり合わせ側管と液体空気で冷やせる突起をつけたものを用い, 燃焼管をすり合わせ側管にいれ, ビュレットの上から真空ポンプで空気を除去します。 ビュレットの下部にゴム管で連結された水銀だめをモーターで押し上げ, 上部の活栓を越して充たし, 活栓を閉じて引き下げるとビュレット内はいわゆるトリチェリの真空になり, ビュレット内壁の吸着ガスは真空に放出されます。 この操作を2~3回繰かえして真空度を高め, 最後に燃焼管の細い端を破壊します。破壊はすり合わせ側管を回転することで行われますが, 複雑な構造になっているので, 詳しくは文献 25)を見てください.
水, 二酸化炭素, 窒素はビュレットの水銀レベルを下げて低圧にし, 3成分の合計体積とそのときの圧力を読みます。次に冷却突起にスリーブをはめ, 液体空気を入れて冷やすと水, 二酸化炭素は凍結しますから, 水銀レベルを上げ, 窒素の体積とそのときの圧力を記録しておきます。 最後に水銀レベルをほぼ常圧に保ち, 二酸化炭素と窒素の合計体積を測定します。 このとき水は常温の蒸気圧を示していますから, 測定時の圧力から差し引くことで, ドライな二酸化炭素と窒素の合計体積と圧力が分かります。 こうして水, 二酸化炭素, 窒素の合計, 窒素単独, 二酸化炭素と窒素の合計が記録されますから, 計算によってそれぞれの成分の標準状態における体積が求められ, 質量に換算できます。
水銀ビュレットは分析室の床から天井に達するほど大きな装置で, 2リットル近い水銀を持ち上げるのですから, 25Kgほどもあってとても人間の力で操作はできません。 何かのはずみでゴム管が外れたら部屋中水銀が流れて大変なことになります。 モーターによる水銀の上げ下げ, 水銀メニスカスを拡大鏡で読んでビュレット内部の圧力の測定, 液体空気による水, 二酸化炭素の凍結, かなり面倒な各成分の計算など, よほど覚悟のできた人でないと繰り返して実行できないでしょう。
この方法が出来上がった頃, 気の弱い日本人が一人キルステンの研究室に超微量分析の勉強にやってきました。 早速封管の作り方を教わり, 圧倒されそうな巨大な水銀ビュレットの操作を細かく指導されました。 手先仕事は割合得意な日本人ですから, かなり短期間に技術をマスターしましたが, 超微量分析にこんな豪快な装置を使うことでかなりのカルチャーショックを受けました。
6-2.封管内測容法
手先だけでできる分析法はないものかと模索の結果, 小さな封管の中に折角水, 二酸化炭素, 窒素を閉じ込めてあるので, このまま外に出さずに中でガス体積を測ることにしました 26)。 最初に試みたのは窒素の分析で, 燃焼管を作るとき試料と銅網のほか小量の水酸化ナトリウムを入れ, 一端を細長く引き, 他端を針にようにして閉じました。 燃焼後針端を下にして水銀を入れたビーカーに突き立てると針端が折れ, 水銀が内部に引き込まれます(図9)。 水銀は上の細管部まで上昇し, 窒素ガスとのメニスカスを示します。細管部を切り取り, 目盛板に貼り付け, メニスカスの位置を記録し, 一度水銀を排出して目盛板の質量を量ります。 最後にメニスカスまでマイクロシリンジで水銀を充し, 質量を測定すれば窒素の体積が計算できます。 ガス体積が重い水銀に置き換わっているので, 極めて正確なガス体積が計算で求められます。 窒素の測定方法はその後いろいろ改善され, 水銀の代わりに50%水酸化カリウム液中で針端を破壊したり, 減圧器でガス体積を拡大して測定するなどが試みられました。 さらに大胆な試みとして, 操作は多少面倒になりますが, 水, 二酸化炭素, 窒素の同時定量も可能としました。この方法で水銀ビュレット法とほぼ同じ効率で分析ができるようになりました 27)。
巨大な水銀ビュレットにたまげた気の弱い日本人とは筆者のことですが, おかげで机の上で作業の出来る方法に切り換えることができました。 しかし随分費用をかけて作られた水銀ビュレットの装置が使われなくなってしまい, お世話になっただけに申し訳ないような気がしています。
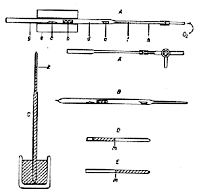
図9.封管内測定法による窒素の定量
6-3.ヘテロ元素の定量
封管法によるN分析やCHN分析は, 超微量分析への利点を残したまま, キャリヤーガスを用いるCHN機器分析法の陰に埋もれてしまいました。 しかし封管法のよさは新しい領域で見直されつつあります。 ろ紙のような燃焼媒体を使わずに微量の試料を燃焼できること, 密閉された空間で時間をかけて反応を完結できることです。 新しい展開はCHN以外のヘテロ元素の分析で実証されました 28)。
ハロゲンや硫黄を含む試料をサブミリグラム領域で量り, 一端を閉じたガラス管に入れ, 酸素を吹き込んで閉じます(図10)。 閉じるとき針のように引いておきます。
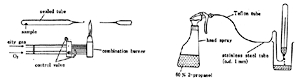
図10.乾式封管法によるハロゲン・硫黄分析
この燃焼管を数本作り, 600℃の電気炉にいれて1時間加熱します。 ガラス管材料にはパイレックス#1720が望ましいのですが, わが国では入手困難です。 そこで普通のパイレックスガラス(#7740)を用いますが, 600℃を超えないよう注意すれば軟化せず, かつ安価ですみます。
燃焼後, 封管の針端を下に向け, 小ビーカーに入れた吸収液の中に突き立てます。針端は折れ, 吸収液が2~3 cm封管の中に吸い込まれます. 吸収液は酸素フラスコ燃焼の時と同じです。 約10分間放置すると燃焼ガス中のハロゲン種はハロゲンイオンに, 硫黄酸化物は硫酸イオンになっています。 封管を持ち上げ, 底からU字形噴射管を差し込み洗浄液でビーカー内に洗い落とします。 吸収液中の成分はそれぞれの方法で定量することができます。
封管の燃焼後, 管内には水, 二酸化炭素, 窒素が生成しており, 未反応の酸素も残っているにもかかわらず, ビーカー内で針端を破壊すると吸収液が吸い込まれ, 管内が弱い減圧になっていることが不思議に思われます。 しかしその理由は水が凝縮して体積を失うこと, 二酸化炭素の発生体積と酸素の消費体積が等しいこと, 封管を閉じるときバーナーの熱が気体膨脹を起こしていたことによります。
ハロゲンイオンや硫酸イオンの定量法は自由に選べますが, 時代にあった方法となると自動滴定装置かイオンクロマトグラフになるでしょう。ハロゲンでは各種イオン選択性電極による電位差滴定が標準的に用いられますが, 滴定の試料液が少ないと感応電極と参照電極を一緒に浸漬するのが困難になります。
双白金電極による分極滴定なら僅かな液量でも実施可能です 29) (図11)。 当量点で鋭いピークが見られます。硫酸イオンの滴定には既述のカルボキシアルセナゾを指示薬とする目視法が一般的ですが, これを光度滴定で行うと一段と再現精度が向上します。 サブミリグラム分析には十分対応できることが分かりました 30)。
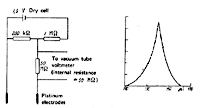
図11.双白金電極によるハロゲンの銀測定
リン, ヒ素, セレンなど燃焼管法では扱いにくい元素の定量も封管法で可能でしょう。 まだ経験がありませんが, リンはポリ燐酸, ヒ素やセレンは酸化物で定量的に残ると思われます。 それぞれの測定法はフラスコ燃焼法と同じです。
有機試料中の金属は塩類や錯体の形で多く存在しますが, 封管中で灰分となり, たいてい酸に溶解して金属イオンとなります. 発色剤を加えて吸光分析にかけるか, 滴定, イオンクロマトなどの方法が選べます。 いずれにしても未知の領域ですから, 個々の金属元素の定量法のノウハウを早く掴みたいものです。
封管法はガラス細工があるというだけでやる気を失う方もあるようですが, 手先の器用な方には結構楽しく, 十数本をまとめてやればかなり能率的で, 分析結果も正確なことが分かります。
7-1.おわりに
閉じ込められた狭い空間で分解, 反応, 吸収を完結する密閉反応器は, 定量分析の究極の目的にかなっています. ある洋酒メーカーのコマーシャルに「なにも足さない, なにも引かない」というのがありますが, 密閉反応器にもぴったりの表現です. 成分の損失も汚染もない密閉反応器には定量分析の原点がまるまる生きづいています. そこに込められたいろいろな工夫を学ぶことによって, 新しい定量分析法の展開が期待できると思われます.
大量のキャリヤーガスや溶媒流で成分を移動させながら, 自動化, 高速化をはかることは時代の要求に沿っていて, 止むをえないことと思いますが, 定量分析の限界をわきまえないと走りすぎて事故を招きかねません。 分秒を争うより, 少しゆとりを持って安全に目的地に到達するほうが賢明のように思います。密閉反応器の定量性には及ばずとも, 出来るだけそれに近づくような機構を考えるべきでしょう。
8-1.参考文献
1) L.Carius: Ann.,116,1 (1860).
2) L.Carius: Ber.,3,697 (1870).
3) F.Pregl; “Die quantitative organische Mikroanalyse”,Springer,Wien, (1916).
4) Al Steyermark: “Quantitative Organic Microanaysis”,Academic Press,New York (1961).
5) 日本分析化学会有機微量分析研究懇談会編: “有機微量定量分析”pp383,南江堂 (1968).
6) S.Parr: J.Am.Chem.Soc., 30, 764 (1908).
7) 内田哲男: ぶんせき,1986, 9.
8) 小島 功: ぶんせき,1990, 291.
9) W.Schoeniger: Mikrochim.Acta, 1955, 123.
10) W.Hempel:Z.angew.Chem., 13, 393 (1892).
11) E.Graefe: Z.angew.Chem.26,616 (1904).
12) G.Stragand,H.Safford:Anal.Chem.,21,625 (1949).
13) H.Safford,G.Stragand:Anal.Chem.,23,520 (1951).
14) 穂積啓一郎: 化学の領域,25,776 (1971).
15) C.Childs,et al: Microchem.J.,7,266 (1963).
16) F.Cheng:Microchem.J.,3,537 (1959).
17) R.Belcher,M.Leonard, T.West: J.Chem.Soc.,1957,3577.
18) 穂積啓一郎,秋元直茂: 分析化学,20,467 (1971).
19) J.Fritz,S.Yamamura: Anal.Chem.,27,1461 (1955).
20) S.Savvin,Y.Dedkov,Y.Makarova:Zh.Anal.Khim.,17,43 (1961).
21) K.Hozumi,K.Umemoto:Microchem.J.,12,46 (1967).
22) K.Novikova,N.Basargin,M.Jsyganova:Zh.Anal.Khim.,16,359 (1961).
23) W.Kirsten:Microchem.J.,7,34 (1963).
24) W.Kirsten:Anal.Chem.,26,1097 (1954).
25) W.Kirsten,K.Hozumi,L.Nirk:Z.anal.Chem.,191,III,161 (1962).
26) K.Hozumi,W.Kirsten:Anal.Chem.,34,434 (1963).
27) K.Hozumi,W.Kirsten:Anal.Chem.,35,1522 (1963).
28) Y.Tanaka,A.Okazaki,K.Hozumi:Mikrochim.Acta,1991,IV, 169.
29) G.Schwab,G.Toelg:Z.anal.Chem.,205,29 (1964).
30) 佐藤綾子: 第65回有機微量分析シンポジウム(北海道大学)講演要旨,p11,(1998).

