

TOPICS
CHNフォーラム
第四部 試薬のはたらき
- 1-1.はじめに
- 2-1.炭水素分析
- 2-2.窒素分析
- 2-3.ハロゲン・硫黄分析
- 2-4.酸素分析
- 3-1.CHN分析
- 3-2.ハロゲン・硫黄分析
- 3-3.酸素分析
- 3-4.その他の試薬
- 4-1.おわりに (著:穂積啓一郎)
- 5-1.参考文献
- 関連装置
1-1.はじめに
分析化学という科学は物質の化学反応やそれに伴う変化現象を捉えて,目的物質の種類や存在量を知るためのものですが,方法が定着してしまうと目に付く装置や操作法はどんどん進歩改良が加えられますが,試薬のほうは割合地味で変化が目立ちません。しかし分析方法ができるまでは試薬も随分あれこれ試行錯誤があったはずで,たまたま当面の目的が果たされて問題なく実用されてはいますが,方法が変わるまでこのままで良いというものではなく,更によいものに置き変わって当然です。
元素分析に使われる試薬は分析目的や分析原理によってさまざまですが,品質や製品形態のほか充填法も分析結果に影響がでるので,適正なものをうまく使うことが必要です。試薬は化学反応をさせるためのものですから,消耗するのが当たり前で,どこまで安心して使えるかの見極めも分析者の責任になります。酸化銅や白金触媒のように原理的には消耗しないものもありますが,一般試料を分析し続けると汚れや表面状態が変化して最初の機能が失われるので,頃合を見て充填物を交換したり,洗浄再活を行う必要があります。
キャリヤーガスを用いる分析法が多くなっていますが,ガスも試薬の一種です。最近は高純度のガスが割合手軽に求められるので,昔ほど不純物の除去に苦労はありませんが,それでも不純物ゼロというものは無いので,購入時にはガスの品位が目的に適合するかどうかを確かめておかなければなりません。大量のキャリヤーガスを使う装置では特に気をつける点です。
固体試薬のほとんどは試薬メーカーの製品をそのまま装置に充填すればよいのですが,吸収液や標準液を作ろうというときは,溶媒や力価検定にさらに別の試薬が必要です。いずれにしてもすべての試薬がそれぞれの役割を完璧に果たしていて,はじめて装置全体がうまく機能するわけですから,相応な知識と保全の努力が望まれます。近年はコンピュータ化が進んで,一部の試薬が消耗変質して反応性を弱めても,標準試料で検出感度を逐次修正すれば暫くまともな分析結果が得られますが,これはカチカチ山の狸が泥舟に乗ったようなもので,いつ沈むか分かりません。
いろいろな分析方法が考え出されて,そのたびに必要な試薬が求められたり作られたりしましたが,分析方法が廃れるとそれらの試薬も要らなくなって,折角苦労して得たものが無駄になることがありました。分析原理としては優れていても毒性や環境汚染への配慮から使えなくなった試薬もあり,結構試薬の分野も苦難の道を歩んできましたが,それでも何とか現代の分析化学を支える名品を作り出してきました。初期の元素分析用試薬はそのまま使えるものばかりでなく,材料を加工して使うものも結構あって,分析技術者の腕の見せどころがありました.こういったことを含めて試薬の歴史と現況を述べてみたいと思います1)。
2-1.炭水素分析
有機物とは生命のある動植物の組織を構成する物質から来た言葉のようで,神の手で作られた神聖なものですが,1828年ヴェーラー(F. Woehler)がシアン酸アンモニウムの加熱により尿素を合成して,有機化合物を人間の手でも作れることを証明しました。19世紀から本格的な有機合成が始まりましたが,原義を尊重して動植物のように炭素を含む化合物を有機物と呼ぶことにしました。炭素を中心に水素や窒素で構成された物質ですから,これらの元素の含有率を知ることはその物質の属性を決める重要なデータです。有機物を燃焼すると物質によって異なる量の二酸化炭素と水を生じることはラボアジェ(A. Lavoisier)によって1784年知られていましたが,リービッヒ(J. Liebig)によって1830年,これらの生成物から炭素と水素の存在率が定量化されるようになり,元素分析技術の幕が開きました。
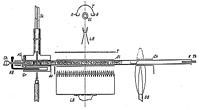
図1.ブレーグルCH分析用燃焼管充填法
電気炉が使われ始めると800℃以上が常識になり,これではクロム酸鉛が溶けてしまいます。そこで燃焼には酸化銅を単独に用い,硫黄とハロゲンの除去には酸化銅の後の低温域に銀線または銀粒を詰めるようになりましたが,硫黄の酸化物のうち二酸化硫黄が完全に捕捉できないという事実が判明し,過マンガン酸銀の熱分解物がこれに代わりました4)。しかしこの試薬は小量づつ作らないと危険を伴うので,わが国では銀粒と酸化コバルトの混合物が考えだされました5)。この国産試薬はサルフィックスの商品名で市販されています。
酸化銅は長い歴史があり,現在も引き続き広く利用されていますが,最大の特長は大きな酸化還元容量を持っていることです。銅は金,銀と共に貴金属元素に数えられていますが,酸素との結合力はあまり強くなく,このため酸化銅は相手が酸素を要求すれば簡単に放出し,自身は還元銅になります。有機試料にはよい酸化触媒で,いったん還元銅になったあと,再びキャリヤーガスから酸素を貰って酸化銅に戻りますから,いわば酸素の銀行業務を行なっているようなものです。
電気炉が普及して温度が上がったものですから,燃焼管は軟化点の高い石英が主流になり,また高速燃焼を期待して900~1000℃に加熱するケースもでてきました。酸化銅では軟化点に近づきますので,もっと高温に耐える酸化触媒として酸化コバルト,酸化ニッケル,酸化タングステンなどが試みられました。ただしこれら酸化触媒の酸素放出能はよく検討されていませんが,多分酸化銅より少なく,燃焼はキャリヤーガス中の酸素から主として行なわれるものと思われます。
窒素を含む試料を燃焼すると窒素酸化物を生じ,二酸化炭素吸収管で捕捉されます。初期には二酸化鉛を燃焼管に詰め,その部分を190℃に加熱して硝酸鉛の形に固定しましたが(図1),水の保留作用が多少あって水素の分析値が不安定になる欠点がありました1~3)。その後二酸化鉛を廃し,代わりに二酸化マンガン粒をガラス管に詰めて水吸収管と二酸化炭素吸収管の間に配置する外吸収法が一般化しました6)(図2)。二酸化マンガンには工業用のものやマンガン電池用のものやいろいろありますが,窒素酸化物をよく吸収しなかったり,また二酸化炭素を吸着するものなどがありました。結局硝酸マンガンから沈殿法で作ったものが元素分析に有効で,炭水素分析が機器分析に変わるまで長く利用されました。
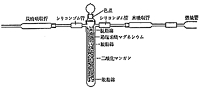
図2.CH分析用外吸収法
最後に燃焼管を出た二酸化炭素と水蒸気を吸収剤で捉えて重量の増加を測るのは定量分析の基本に沿っていて,なにも問題が無さそうに思いますが,さて実際にどういう試薬を用いるかとなると,最初はいろいろ曲折があったようです。古いことで詳しいことは分かりませんが,二酸化炭素の吸収には水酸化カリウムの濃厚溶液が使われています。リービッヒのカリ球(図3)というものが知られていますが,ガスをくぐらせて接触をよくしながら外に液が出ないように工夫してあります。その上出入り口のガラス管を曲げてはかりに吊るしやすくしています。水酸化ナトリウムを使わなかったのは,水に対する溶解度が低いことと,従って溶液の水蒸気圧が高くキャリヤーガスで減量することによります。固体の水酸化カリウムの粒をガラス管に詰めてもよかったのですが,表面が炭酸水素カリウムに覆われてすぐ使えなくなり,結局内部に拡散できる濃厚水溶液を用いることになったと思われます。
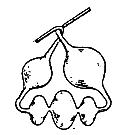
図3.リービッヒのカリ球
水蒸気の吸収剤には五酸化リンが最も強力な試薬として古くから知られていましたが,粉末状で通気が悪く,しかも表面がリン酸のシロップで覆われるという欠点があります。それでもこれを使おうというときは,五酸化リンを軽石などにまぶして通気性をよくしました。ただし軽石にはあまり沢山の五酸化リンが付着しませんので,寿命は長くありません。濃硫酸も吸収剤として優れていますので,カリ球と同じガラス容器に入れて利用できたと思われますが,危険な物質なので使われませんでした。最終的には塩化カルシウムの粒子をU字管に詰めて実用されましたが(図4),この試薬は水を吸収すると収縮するので通気阻害がなく,優れた吸収剤として長く用いられました。
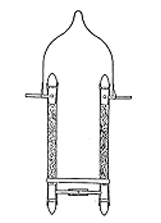
図4.U字型水吸収管
1910年頃プレーグル(F. Pregl)が微量分析を始めると小型,軽量の吸収管が必要となり,上記カリ球やU字管の形態では使い難く,ガラス円筒の吸収管に吸収試薬を充填する方法を採用しました。水吸収剤には粒状塩化カルシウムが引き続き使われましたが,二酸化炭素吸収剤には最初グラスウールに濃水酸化カリウム液を沁みこませて用いました(図5)。

図5.初期の二酸化炭素吸収管
しかしたまたまソーダ石灰というものが作られて,これは二酸化炭素を内部までよく吸収するので,早速これを利用しました。この試薬は濃水酸化ナトリウムと生石灰を混合加熱し,冷後粒状にしたもので,現在でも安価な二酸化炭素吸収剤として製造されています1)。ガラス管は外径8 mm,長さは水吸収管が8 cm,二酸化吸収管が10 cmで,両端に毛管部分を設けキャリヤーガスの通気と湿気の侵入防止をはかっています。充填した吸収管は10グラム前後になり,20グラムの最大荷重で設計された微量はかりで精密計量が可能です。
1930年頃プレーグル法がわが国に伝わってきてから,多くの大学や企業の研究室で炭水素分析が実施されるようになりましたが,夏になると分析結果が乱れるという現象が共通して起きました。空調機のない時代ですから,高温多湿の分析室で操作すれば水吸収剤の吸収能が悪くなったり,吸収管の計量中に両端にある毛管を通じて湿気が侵入したり,あるいは流路の連結部のゴム管からの水分の拡散ではないかなどあれこれ検討を重ねたのですが,一向に改善せず,夏は分析を引き受けないところもあったようです。
欧米の文献にはあまり真剣に取り上げられなかった現象で,わが国の技術がまだ未熟であるからと勝手に納得する向きもあったようですが,第二次大戦の後これでは国際的な有機化学の進歩に取り残されると心配する方々が大勢あって,1950年頃から大学,企業の研究室で重要なテーマになりました。
戦後の国際情報が少しづつ入ってきましたが,試薬の面でも相当新しいものが作られていました。二酸化炭素吸収剤にはソーダアスベスト,水吸収剤には過塩素酸マグネシウムが欧米で使われているようで,それも簡単には手に入らないことから研究室で試作を始めました。ここでは京都大学農学部の故三井教授の苦労が実を結んでいます。
ソーダ石灰は既述のように水酸化ナトリウムと生石灰の混合物ですが,後者は二酸化炭素の吸収作用がほとんどありませんので,水酸化ナトリウムの担体として表面積を広げ,反応性をよくしようという目的であったようです。同じ考え方を繊維状のアスベストに期待して作ったのがソーダアスベストですが,研究の結果担体としてよりアスベストに含まれる水分が反応性を高めると分かりました。実際ソーダアスベストを脱水乾燥して用いるとほとんど二酸化炭素を吸収しません。アスベストを加える別の利点は,出来上がった吸収剤が黄褐色になり,二酸化炭素を吸収した部分が白くなって消耗状態が分かるという利点がありました。
この研究結果から5~10%の水を含む水酸化ナトリウム粒(10~24メッシュ)が作られましたが,無色なので酸化銅を小量混合して黒く仕上げています。この黒い粒子は二酸化炭素を吸収するとその表面が白くなります。ソーダアスベストも平行して国産化されましたが,近年アスベストが有害物質に挙げられたため,無害なタルク(ケイ酸マグネシウム)をこれに代え,ソーダタルクの名称で市販されています7)。
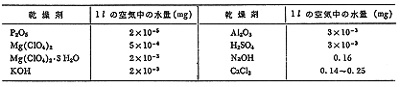
水吸収剤も戦後過塩素酸マグネシウムが現れ,長く用いられた塩化カルシウムに置き換わりました。この試薬は特にわが国の元素分析にとって救世主的な役割を果たしました。キャリヤーガスの乾燥,水吸収管の充填,二酸化炭素吸収管の後尾に用いると,それまで夏季に分析が出来なくなるなどのトラブルからすっかり開放されました。いろいろな脱水乾燥剤の能力が調べられ,25℃では表1のようになりました。1リットルの飽和水蒸気を含む空気を通じると,過塩素酸マグネシウムでは1μgほどの水が通過するだけですが,塩化カルシウムでは200μg近くなり,これでは水吸収管や二酸化炭素吸収管の計量値が不安定になるのは無理ありません。ましてわが国の夏日ともなれば40℃を超える環境での分析作業ですから,塩化カルシウムではとても定量できなかったことが理解できます。
表1.乾燥剤の吸水能力
2-2.窒素分析
有機化合物の機能を特徴づける大切な元素で,存在の有無と存在量は重要な化学情報です.リービッヒの炭水素分析と同じ頃ジュマ(J. Dumas)によって乾式法が考案されました (図6)。一端を閉じた燃焼管の底に炭酸マンガンを詰め,この上に酸化銅,試料+酸化銅,酸化銅,還元銅を入れてアゾトメータに連結します。はじめに炭酸マンガンを加熱して二酸化炭素を発生させ,空気を追い出し,そのあと燃焼管全体を加熱すると試料が燃焼して窒素が生成しますので,二酸化炭素と共にアゾトメータに送り込みます。アゾトメータは50%水酸化カリウム液を入れたガスビュレットで,窒素ガスのみが溶けずに目盛にたまります。この方式はプレーグルの微量化においても,二酸化炭素をキップの装置で供給したほかは変わらずに受け継がれました。
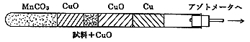
図6.最初のジュマ充填法
微量化で苦労したのはキップの装置で得られる二酸化炭素の純度で,50%水酸化カリウム液に吹き込んだとき全部を溶解させなければなりません。とは言っても吹き込んだ泡がゼロにはならないので,分析結果に支障が出ない程度の微泡になるよう手を尽くしました。用いた大理石の銘柄や塩酸に溶け込んだ空気の追い出しに関心がもたれました。銘柄といっても見て判断できるものでなく,使ってみてよければ購入ルートを覚えておく程度ですが,一方塩酸のほうは表面を第二のキップ装置から供給する二酸化炭素で覆い,空気の溶解を避けるなど実に大層なことをしました。全く窒素を含まない二酸化炭素が出てくるまでには相当無駄な放出がありました。
そのうちドライアイスが手に入るようになってこれを魔法瓶に入れ,自然気化の二酸化炭素を使うようになってようやく厄介なキップの装置から開放されました。数リットル容量の大型ジュワー瓶を特注して,ドライアイスを入れると,無くなるまで一週間ほどは使えました.現在では液化炭酸が手軽に使えるようになって以上の苦労はすべて昔話になりました。
燃焼管の充填物は炭水素分析に比べて単純で,還元銅の層を固定的に詰め,酸化銅を毎回ニッケル皿で焼いて充填しました。キャリヤーガスが二酸化炭素なので,酸化銅は試料ガスで次第に還元されるからです。試料そのものは試験管の中で粉末酸化銅と混ぜ,最後に注入しました.充填を終わった燃焼管は燃焼炉で還元銅と酸化銅の層を加熱した上,試料部分をバーナーなどで徐々に加熱して行きました。
酸化銅と還元銅を同じ炉で加熱したものですから,少々問題が生じました。燃焼を完全にするには高い温度が必要ですが,あまり高くするとアゾトメータの微泡が得られなくなります。当時はよく理由がわからなかったので,両者の妥協点で操作するなど苦肉策も取られましたが,間もなく原因が分かりました8)。二酸化炭素は600℃以上で還元銅により一酸化炭素を生じ始めるので,これがアゾトメータの泡になり,微泡が得られません。
CO2+ Cu → CO + CuO
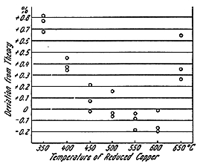
図7.還元銅の適正温度
一方還元銅は500℃以下では窒素酸化物(NOx)から窒素への還元が困難になります。いずれの場合も窒素値が+の誤差を生じますので(図7),還元銅は500~550℃,酸化銅は800~900℃と別の炉で加熱するという現代の手法が定着しました。
2-3.ハロゲン・硫黄分析
炭水素分析や窒素分析が有機化学の構造確認に早くから利用され,歴史が古いのは分かりますが,少々脇役のハロゲン・硫黄分析もあまり遅れずにカリウス(L. Carius 1829~1875)によって方法が見つけられました。燃焼法では単一の気体成分にならないので,湿式分解の道を選びました。厚肉のガラス管に試料と発煙硝酸を入れて閉じ,300℃付近に加熱分解します。ハロゲン分析にはあらかじめ少量の硝酸銀を,硫黄分析には塩化バリウムを加えておくと,それぞれハロゲン化銀,硫酸バリウムの沈殿を生じるので,後で濾過して沈殿量を測定します2,3)。
徹底したマニュアル操作ですが,定量分析の原理からは優れた方法です。塩素の場合Cl = 35.5からAgCl = 169.8と約5倍,硫黄のときはS = 32.1からBaSO4= 233.4と約7倍になるのですから,質量測定の技術もそれだけ楽になります。ただし封管はひずみが残らないよう均一に加熱しながら作らないと爆発の危険があり,中の発煙硝酸が飛び散っては後始末が大変です。
プレーグルは微量化に当たって封管法を避け,酸素をキャリヤーガスとした燃焼管法を採用しました2)(図8)。白金板を触媒として試料の分解を促進しています。燃焼ガスは炭酸ナトリウム液で濡らせたガラス玉に吸収され,後で燃焼管を炉から取り外し,ビーカーに水で洗い込んでハロゲンイオン,硫酸イオンの形で定量します。このときやや多量の炭酸ナトリウムや添加試薬を必要としますが,その中にハロゲンや硫黄関連の不純物がないか,もしあれば精製して使うよう方法まで指示されています。現代のように特級試薬がない時代ですから無理もない心配です。

図8.ブレーグルのハロゲン・硫黄分析用燃焼管
戦後になるともっと手間のかからない燃焼管と加熱銀を組み合わせた乾式分析法が現れ9)(図9),この方法は一時期世界中に広がりました。ハロゲンはハロゲン化銀,硫黄は硫酸銀として銀の表面に固定されますので,ほとんど試薬の要らない分析として評価されました。ただしハロゲン分析の場合,銀の増量がそのままハロゲン量になりますから,よほど正確に銀の質量を測らなければなりません。幸いこの頃微量はかりの測定精度が著しく向上して,なんとか微量分析の要求に応えることができました。
図9.加熱銀によるハロゲン・硫黄分析
折角加熱銀法が定着し始めたのに,1955年酸素フラスコ燃焼法10)という新手が現れ,たちまち疾風のように世界中を駆け巡りました。これについては本文書シリーズの「フラスコ燃焼法と密閉反応器」の項にまとめてありますので参考にしてください。フラスコ燃焼法は道具建てが簡単というメリットは大いにありますが,その他では湿式の昔に戻ったわけで,またいろいろな試薬のお世話にならざるを得ないという皮肉な面もありました。最近はイオンクロマトと組み合わせた方法が使われ始めていますが,ハードウエアに経費がかかるので,この点も今後の問題でしょう。
2-4.酸素分析
有機化合物中の酸素は分布が広いのに,分析法としては後発に属します。1940年ウンターザウハー (J. Unterzaucher) によって実現されました11)。試料の分解には酸化が一番手っ取り早いのですが,酸素を定量するのに酸化はできませんから,高温の炭素と反応させて一酸化炭素を生成させる方法がとられました。1120℃の高温が必要で,これに耐える電気炉や石英管の素材選びだけでも昔は大変であったと思われます。この温度になると炭素と石英とが反応して一酸化炭素を生じ始めるので,常に僅かなブランクが現れ,これを一定に保つため温度を±5℃とか厳重に規制しました。
ここで用いる炭素粒は,ガスカーボンという低級炭化水素ガスを無酸素で加熱した煤を粒状に練ったものですが,工業製品ですから灰分が少々含まれています。ケイ酸質や金属酸化物が多いようですが,フッ化水素酸で洗えばかなり除去されます。灰分を含まない炭素粉を得るには,グルコースをゆっくり加熱して脱水炭化させればよいのですが,結構技術が要ります。
1954年Oita (I. Oita) によって50%白金-炭素粒が提案され,900℃で反応が出来るようになりました12)。電気炉も炭水素分析用のものと同じで,温度が低いだけにブランクも随分小さくなりました。この試薬は塩化白金の水溶液に当量の炭素粉を混和し,一度蒸発固化した後砕いて石英管に詰め,窒素を通じながら900℃に加熱して作ります。半分が白金でひどく贅沢な試薬と思われますが,白金の密度は21.5もありますから,試薬の中に占める体積は5%ほどに過ぎません。古い白金ボートなどを王水に溶かして白金-炭素粒を作ろうという方がありますが,ロジウムなど強化材が入った合金ですから,溶かすのも大変で,お奨めできません。それでも経費を節約したいというときは,燃焼管に充填した試薬の内,入り口付近の3分の1ほどを時々更新すればよいかと思います。
酸素分析は他の元素分析より少々遅れて現れたばかりに,化合物の構造確認にやや脇役のような感がありますが,本来は同格の使命を持っています。特に水は89%が酸素ですから,含水物,付着水の検出に役立つでしょう。CHN分析の値がおかしいというときは酸素分析値を検討すべきです。ポリエチレンのように化学構造上酸素原子がないのに酸素分析で値が出ることがあります。高分子材料の酸化による劣化などで見られる現象ですが,その他にも酸素分析の活用の場はいろいろあるようです。
生成した一酸化炭素の定量には五酸化ヨウ素との反応が主として用いられました。固体のこの試薬は120℃で定量的にヨウ素と二酸化炭素を生成します。
5CO+I2O5=5CO2+I2
初期はヨウ素をアルカリ液に吸収させ,このあとヨードメトリーの手順に従ってチオ硫酸ナトリウム標準液で滴定するのが一般でしたが,いろいろな試薬を使って結構煩わしく,そのうちヨウ素を加熱銀粒で除去して二酸化炭素を炭水素分析用の吸収管で吸収するという方法がもっぱら採用されました。
一方試料の熱分解によって水素やエチレンなどが生成しますが,五酸化ヨウ素と反応し,定量的ではありませんがヨウ素や二酸化炭素を発生させますので,いずれも定量の妨害となります。そこで元素分析用にはヨウ素酸HIO3を一部脱水させた無水ヨウ素酸HIO3・IO5が使われています。製造にはかなり技術が要る試薬で,単一物質ではありませんが,総合的に必要な特性を備えています。酸素分析にも機器的手法が導入されつつありますが,一酸化炭素を二酸化炭素に変える無水ヨウ素酸(通称五酸化ヨウ素)の出番は当分確保されています。
3-1.CHN分析
1960年代の電子化の波が元素分析の領域に押し寄せて,いわゆるCHN分析が重量法,容量法の装置を分析室から追い出してしまいました。外観的には何もかも変わったように見えますが,CHN分析装置の中で行なわれる分析化学反応はそれまでとほとんど変わっていません。多少変わったことと言えば迅速分析を志向してキャリヤーガスの流量を上げ,熱分解反応の促進に温度を高くしたことで,これが試薬のほうにも影響を与えています。
酸化銅は歴史の長い燃焼触媒ですが,実際には黒い酸化第一銅Cu2Oと赤い酸化第二銅CuOの混合物です.1100℃付近で半融しますので,使用温度は900℃あたりが限度です。純粋な電気銅線を空気を通じながら電気炉で加熱して作りますが,表面から酸素を吸収して次第に内部に向かって酸化銅が出来るとき体積が増えるので隙間ができ,中まで多孔質になっています.酸化銅と試料の分解ガスとは内部まで反応の場があり,しかも銅の貴金属性によって簡単に単体金属に戻りますから,多量の酸素を相手に供給して酸化容量も大きい特長があります。キャリヤーガス中の酸素を必要最小限に押さえて燃焼する方式の分析法(図10)では,引き続き有用な充填剤です。
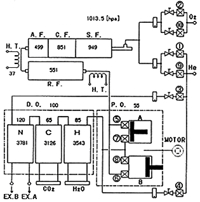
図10.酸素添加法によるCHN分析
しかし最近の高速分析の志向は,かなり太い燃焼管を用い,大流量のキャリヤーガスを流し,1000℃付近の高温で瞬時に分解しようという傾向を生んでいます(図11)。このため試料の燃焼を100%の酸素雰囲気中で行い,燃焼触媒に高耐熱性の酸化クロム,酸化セリウム,酸化タングステンなどをベースにしたものを試みています。フッ素の除去を兼ねた酸化カルシウムと酸化セリウムの焼結物も提案され,有効であるとの報告がされていますが13),今後の推移を見守りたいと思います。
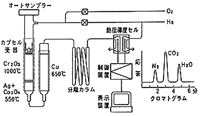
図11.高速燃焼法CHN分析
ハロゲン,硫黄除去用のサルフィックスはわが国で開発された優れた試薬です。酸化コバルトと酸化銀の混合物を600℃で加熱処理したもので,酸化銀は微粒子の銀になって酸化コバルト粒子内に分散しています。ハロゲンは銀粒のみでも除去できますが,二酸化硫黄はサルフィックスを用いることで硫酸銀として固定できます。この試薬は普通燃焼管の出口付近に充填し,燃焼炉の温度の下がったところで500℃前後を想定していましたが,実際にはもっと高い温度になっているケースがあるようで,これでは硫酸銀が解離して二酸化 硫黄を定量的に固定してくれません。そのためサルフィックス専用の500℃の炉を設ける分析装置が作られています14)。
還元銅は元素分析法のスタートから使われてきた衰えのない試薬です。一度酸化銅としたものを300℃以下で水素で還元して用いますが,純水素を使うと高温に発熱して半融状態になり,表面積が減少して還元力が乏しくなります。窒素など不活性ガスで10%ほどに薄めてゆっくり還元すべきです。試薬メーカーでは新しい還元銅をガラス管に封入して供給していますが,これをガラス瓶に入れかえると空気中の酸素を吸って黒ずんできます。燃焼管に充填した後も分析回数とともに酸化が進んでゆきますが,再還元のときは薄めた水素でゆっくり還元しなければなりません。
還元銅に代わる試薬の提案も無いではありません。酸化タングステンの粒子から還元タングステンを作った報告があります。銅に比べて耐熱性が高いので,最近の高温燃焼システムには向いているかも知れません15)。その他安価な還元鉄を使い捨てにするという方法もありそうに思えますが,まだ誰もやっていません。
二酸化炭素吸収剤にはソーダアスベストから安全なソーダタルクへの交代がありましたが,機能的には何も変わっていません。二酸化炭素を吸収すると膨張し,水分の保留力が無くなって泥状になり,極端な場合キャリヤーガスが通らなくなります。CHNコーダーのように二酸化炭素吸収管が検出器の流路に組み込まれたものでは,吸収管の両端に圧力差が発生し,ベースシグナルが乱れてきます。吸収管が詰まってしまえば異常に気づきますが,詰まりかけでは見逃す可能性があります。
二酸化炭素吸収管が最後まで詰まらない工夫として,ソーダタルクに中空のガラスビーズを混ぜる方法(嵩で3:2)があります16)。ガラスビーズは嵩密度がソーダタルクに近いので均一に混ざります。ビーズ入りの吸収剤も市販されていて,これを使ってベースシグナルを連続記録した実験結果も発表されています。ソーダタルクは元素分析装置全般にキャリヤーガスの精製や酸性ガスの除去によく使われていますので,流路系の詰まり防止にこの試薬は貢献できるでしょう。
3-2.ハロゲン・硫黄分析
フラスコ燃焼法は単に試料の分解方法を与えただけですから,このあと吸収液の処理法は何をしてもよいわけで,初期は目視滴定法が主流でしたが,現在は電位差滴定,吸光度測定,イオンクロマト法に移っています.塩素,臭素,ヨウ素イオンにはそれぞれイオン選択性電極があり,自動電位差滴定装置でデータがプリントアウトされますが,この「選択性」は一種類のハロゲンイオンにだけ感応するというものではないので,混合ハロゲンイオンには使えません。ただし単一ハロゲンイオンには極めて精密な測定法になります。
ハロゲンイオン電極にはハロゲン銀を圧縮成形した円板がはめ込まれていますが,試薬とは言えないものの,試薬のような作用をしています17)。水溶液と接すると電極表面の薄層にハロゲンイオンと銀イオンが溶け出し,電極材料と平衡しています。
AgX ⇔ Ag+ + X–
溶解度積K =[ Ag+]×[ X-]は一定ですから,試料中のハロゲンイオン濃度が変わるとそれに応じて銀イオン濃度も変わり,結果として表面に存在する銀イオンが電極材料に浸透する量が変化して電極電位が決まります。 電極表面でのハロゲン銀の溶け出し方が再現する必要がありますが,沈殿物で表面が汚れたり,油気がついたりしてはうまく機能しません。洗剤でよく洗った鹿皮を揉みほぐし丁寧に拭い取ることで機能的な表面がよみがえります。
フッ素イオンにもイオン選択性電極がありますが,沈殿滴定では鋭い変曲点が得られ難いので,直接電位差測定に使います18)。ここではイオン活量係数を一定にするためTISABと呼ばれる緩衝液を加え,標準液で作った濃度対電位の検量線で試料溶液のフッ素濃度を読み取りますが,濃度の対数が電位に比例するので,電位差計は0.1mVの読み取り精度を持った精密級のものが必要です。TISABの作り方は,まず500 mlの水に氷酢酸57 g,塩化ナトリウム58 g,クエン酸ナトリウム0.3 gを加え,5 mol/l水酸化を用いてpH 5.5に調製し,水を加えて全量1000 mlとします。電極メーカーの提供するTISABもありますが,連続分析ではかなりの量が要りますので,ありふれた試薬を集めて自分で作るほうが賢明です。
もう一つのフッ素定量法に少しクラシックですが吸光度測定があります19)。アリザリンコンプレキソンというクロモトロープ系の色素があり,硝酸セリウムを加えて赤紫色の錯体にしておきます。これにフッ素イオンが加わると青色の複合錯体に変わることを利用したものです。日本薬局方など公定法に採用されているので,医薬品の分析にはこの通りしなければなりませんが,一般にはランタン錯体にして緩衝剤も加えた市販のアルフッソンという粉末薬品を水に溶かして用いるのが便利です。
どちらの試薬も濃い赤紫色をしていて,それ自身かなりの吸光度があります。フッ素が加わって620 nmの波長域に生じる僅かな吸光度変化を測定するので,分光光度計は感度のよいものを使用しなけれなりません。吸光度にして0.001が安定に読み取れることが必要です。
硫黄の定量にはカルボキシアルセナゾを指示薬に用いるバリウム滴定が主流になっていますが,目視滴定では赤紫から青になる当量点を捉えるのに,標準液の当量点の色と比較しながら繰り返し練習しなければなりません。最近電位差滴定装置の電極を外し,代わりに光度滴定のセンサーが取りつけられるものがあり,同じ滴定を660 nmの波長で滴定すると当量点で急峻な光度変化があり,高精度な滴定結果が数値で得られることが分かりました20)(図12)。
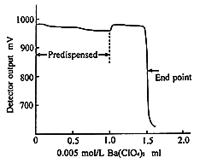
図12.硫黄イオンの光度滴定
イオンクロマト法を使うと各種ハロゲンや硫黄の一斉分析が可能で,将来的な発展が期待されます。溶液を扱うので湿式分析の一面から離れられませんが,試料液を装置に注入してからは自動化が進んで操作的には乾式分析に近くなっています21)。溶離液とイオン交換樹脂の組み合わせが重要ですが,ハロゲン・硫黄分析では0.002~0.004 mol/l程度の希薄な炭酸ナトリウムと炭酸水素ナトリウム混合液が溶離液として用いられ,またイオン交換樹脂にはポリスチレン系の基材の表面を四級アンモニウム化したものが利用されます。最近はポリメチルメタクリル系の樹脂を基材にすると各種ハロゲンが一層バランスよく分離されるという報告がされています。いずれにしてもこの樹脂はごく表面だけがイオン交換できる低容量の材料ですから,汚れには弱く,カラムには微粒子や余計な化学物質を流してはなりません。通常ガードカラムを前に配置していますが,本来の分離カラムを守るためにはあまり長く使わず,時々交換すべきです。
イオンクロマト装置の試料液注入ポートには100μlほど取りこまれますが,試料液自体が溶離液に近い組成を持っていることが望ましいとされています。フラスコ燃焼で塩素の分析を行なう場合でも,水だけというのは僅かにベースラインを乱し好ましくありません。フラスコ燃焼の吸収液はしたがって上記の溶離液をベースにして,これに必要あれば過酸化水素やヒドラジンを加えたほうがよいでしょう。
サプレッサー型イオンクロマトの最終段階ではネフィオン膜を介して脱陽イオン反応を行ないます。デュポン社の開発したこの不思議な膜は径の小さな陽イオンだけを通過させますから,溶離液をこの膜でできた管に流し,外側に径の大きなドデシルベンゼンスルフォン酸を向流させると,径の小さなナトリウムイオンは溶離液から膜の外側に抜け,代わりに水素イオンが入ってきて炭酸イオンは二酸化炭素と水になります。溶離液の電気伝導性がこれで失われますから,試料イオンのみの伝導性が測定できます。
Na2CO3 → 2Na+ + CO32-
2Φ-SO3H + 2Na+ → 2Φ-SO3Na + 2H+
CO32-+2H+ → CO2+ H2O
電気伝導度の低い溶離液を使って脱イオンを省略したノンサプレッサー型の装置もあり,値段もそれだけ安いメリットがありますが,精度の高い分析結果を望むならやはりサプレッサー型に軍配が上がります。それは感度がよいということと電気伝導度の再現性がよいという理由からです。電気伝導度は温度の関数で,1℃温度が変わると電気伝導度は2%ほど変わります(図13)。0.1%の再現精度を求めるには検出器温度は±0.05℃が必要です。恒温槽で温度制御はしていますが,安価な装置はそれなりに作ってありますので,細かく比べるとサプレッサー型のほうが精密になっているようです。
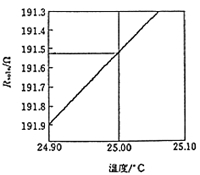
図13.電気伝導度の温度変化
3-3.酸素分析
電子化の傾向はこの領域にも及んでいますが,試薬に関しては大きな動きはありません。白金-炭素粒は引き続き信頼できる一酸化炭素変換触媒として広く使われていますが,モリブデン-炭素も提案されています22)。貴金属を使わない点と,硫黄や砒素などで被毒による活性低下がないことが特長のようですが,まだ製品化されてはいません。
一酸化炭素を二酸化炭素に酸化する方法には,酸化銅を用いるか五酸化ヨウ素を用いるかがありますが,前者は低級炭化水素を酸化する可能性があるので温度に注意しなければなりません。300℃あたりが適当といわれます。後者は120℃前後で完全酸化しますので装置的にも簡単になります。ただ生成したヨウ素を除去しなければなりませんが,同じ温度の銀粒で吸収できますのでさほど面倒なことではありません。こうして変換された二酸化炭素はCHN分析計の炭素シグナルとして取り出すか,独立した酸素分析計では非分散赤外計で測定されます23)(図14)。
非分散赤外計は半導体赤外センサーでコンパクトに作られていますが,原理的には一酸化炭素の直接測定もできます。しかしこれでは感度が低いので,面倒ですが二酸化炭素に変換したほうが得策です。O=Cの伸縮振動よりもO = C = Oの逆対称伸縮振動のほうが赤外線吸収効率がよいからです。
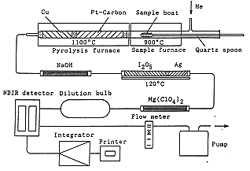
図14.非分散赤外計を用いる酸素分析
3-4.その他の試薬
元素分析用標準試料は分析機器の感度を決定したり,分析誤差のばらつきを測るため重要な働きをしますが,別稿「測定値を支える標準の役割」で概略を述べましたのでここでは省略します。
日常分析に直接使用される試薬類は大体市販品が使えますが,滴定液や指示薬,発色剤,クロマト溶離剤などは自分で調製しなければならず,少し新しい方法を試みるときは自製したり市販品を加工したりしなければなりません。ここで用いる原料薬品は原則的にJIS特級試薬で,日本薬局方の試験も同じように指定されています。特級試薬は一級試薬の上にランクされていますが,100%の純品とは限りません。通常ラベルには純度の表示がありますが,中には努力しても純度の上がらぬ物質もあり,例えばアルセナゾなどは特級,一級の区別がありません。
著名な外国の試薬もありますが,品位としてはAnalytical reagent gradeとReagent gradeがあり,わが国の特級,一級に相当するもののようです。国によってはM.A.R. (Micro Analytical Reagent) の品位を表記したものがありますが,これは微量分析用で一番信頼が置けます。試薬の種類は多いので,特殊なものを使って見ようというときは,大手の試薬商社で国内,国外両方のカタログを調べてもらう必要があります。
水や溶媒も試薬同様おろそかにできません。溶液は溶質よりも圧倒的に溶媒のほうが多いのですから,溶媒中の僅かな不純物も問題になります。まず分析に使われる「純水」とは蒸留水かイオン交換水のことですが,元素分析では蒸留水を使わなければなりません。最近は蒸留水を買うケースが増えていますが,水道水から蒸留するときは,一回の蒸留では消毒用の塩素ガスや飛沫が混入するので,二回蒸留するとよいと言われます。イオン交換水は樹脂で脱イオンされていますが,中性の有機物が残っている可能性があります。一番よいのはイオン交換水を蒸留したものです。
水はいろいろなイオン種を溶解しますが,ガラス容器からのアルカリ金属イオンやケイ酸,ホウ酸イオンの溶出には注意が必要です。一般的にはポリエチレン瓶が安全で,かなり大きな容器も作られています。他のプラスチックに比べ添加剤がほとんど入っていないのが特長です。
有機溶媒は蒸留を繰り返すしかありませんが,単に物質を溶解するだけであれば必ずしも純粋で無くてもよいと言えます。紫外部の吸光度の測定などに必要な純粋溶媒を得るには理論段数の多い精密分留装置を用いますが,装置内部にかなりのホールドアップが必要で小量の原料からはやり難いと思われます。エタノール中のアセトンやシクロヘキサン中のベンゼンなどが問題となりますが,普通試薬瓶のラベルに不純物含量または規格合格の表示がしてあります。まれなケースですが有機溶媒から水を除くこともあり,これには無水硫酸ナトリウムが安全で一般に利用されます。炭化水素系の溶媒から痕跡の水を除くには線状の金属ナトリウムが有効ですが,危険な物質ですから十分注意しなければなりません。
キャリヤーガス法が現代の主流になっていますが,気体の燃焼成分を運ぶのみならば分析反応に関係しません。しかし大量のガスを流すので僅かな反応性不純物があると問題となることがあります。CHN分析に使われるヘリウム中の水分,窒素,酸素,炭化水素などが空試験値に影響しますが,近年分析用の高純度ガス (99.999%以上) が手軽に入手できるようになって大抵そのまま使えるようになりました。ただしこれはわが国を含む限られた先進国での話で,それ以外では何らかの対策が必要なようです。
燃焼添加剤としての酸素も窒素やアルゴンを含まないことが重要ですが,これも高純度のものが市販されています。鉄材の溶接や酸素吸入用に使う安い酸素が出まわっていますが,窒素や水分が混じっていることがあり,利用できません.水素は還元銅の再活に不可欠ですが,3.1で述べたように10%程度に希釈したものが適当で,水素と窒素またはヘリウムを流量計で測りながら混合してもよいのですが,ガス販売商社に申し込めば混合ガスを作ってくれます。濃度の検定を要求しなければさほど高価なものになりません。純水素の高圧ボンベは甚だ危険なものですから,それを避けるためにも希釈水素ボンベを備えるべきです。
4-1.おわりに
試薬は化学反応を通じて物質を認識するためのものですから,期待される反応が円滑に行なわれ,同時に余計な現象が持ち込まれないことが重要です。純度の高い試薬が先ず要求されますが,使用条件,例えば温度,濃度など,あるいは保存状態,吸湿,汚染なども誤った結果の原因になります。非常に単純な化学反応のように見えても,真に一本道を一方通行だけする反応は理論的にないので,必ず副反応と逆反応が存在します。量的に副反応や逆反応が無視できるような条件を選んで先人達が分析方法を開拓してくれたお陰で,今日驚くほど正確な元素分析ができるわけですが,その苦労を無に帰すような使い方をしてななりません。また化学反応は異なる分子種が相互に衝突して新しい物質をつくることで進行しますから,全部がこの過程を終了するには時間がかかります。微量,希薄の条件では一層衝突反応が起こり難くなっていますから,一つの反応が完結するまで待って次の反応に進むことも肝要です。常にある程度ゆとりのある分析プロセスが安全ですが,能率第一に分析のサイクルを短くすると,どこかに無理がないか十分安全を確かめる必要があります。
5-1.参考文献
1). 日本分析化学会有機微量分析研究懇談会編: “有機微量定量分析”,pp123,南江堂 (1969).
2). F. Pregl: ”Die quantitative organische Mikroanalyse”,3 ed, Springer, (1930).
3). Al Steyermark: ”Quantitative Organic Microanalysis”,2 ed, Academic Press, (1961).
4). J. Koerbl: Mikrochim. Acta, 1956,1705.
5). T. Mitsui, et al: Mikrochim. Acta, 1962, 385.
6). R. Belcher, G. Ingram: Anal. Chim. Acta, 4, 401 (1950).
7). キシダ化学有機元素分析用試薬カタログ,(1997).
8). K. Hozumi, S. Amako: Mikrochim. Acta, 1959, 230.
9). G. Stragand, H. Safford: Anal. Chem., 21,625 (1949), 23,520 (1951).
10). W. Schoeniger: Mikrochim. Acta, 1955,123, 1956,869.
11). J. Unterzaucher: Ber. 73B, 391 (1940).
12). I. Oita, H. Conway: Anal. Chem., 26, 600 (1954).
13). 宗石和晃,加門邦彦,井上佳久: 第67回有機微量分析シンポジウム講演要旨(2000).
14). 奥宮正和,林かずよ: 第62回有機微量分析シンポジウム講演要旨 (1995).
15). 松林國男,H. Sieper,H. Kupla: 第65回有機微量分析シンポジウム講演要旨 (1998).
16). 佐藤綾子,穂積啓一郎,福田史隆: 第66回有機微量分析シンポジウム講演要旨 (1999).
17). 穂積啓一郎: 化学の領域,26, 881 (1972).
18). 穂積啓一郎,秋元直茂: 分析化学,21,1479 (1972).
19). 小野江敏江,島田 潜: 三共研究所年報,17,82 (1965).
20). 穂積啓一郎,佐藤綾子,秋元直茂: 分析化学,47,217 (1998).
21). 長島 潜,岡本利光,出羽 好,服部隆俊: 分析化学,49,337 (2000).
22). 板谷芳京: 第57回有機微量分析シンポジウム講演要旨 (1990).

